丂丂慜夞乽峈僀儞僼儖僄儞僓栻傪擼峓嵡偺嵞惗堛椕偵乿偲偄偆僾儗僗儕儕乕僗傪徯夘偟偨偑丄偦偺屻撉傒曉偟偰傒偰傆偲巚偭偨丅
丂乽擼峓嵡偺崻杮揑帯椕偵惉岟偟偨悽奅弶偺尋媶偱偁傝乿偲偄偆婰弎偑戝偄偵婥偵側偭偨丅
丂挿擭偄傠偄傠側婡娭丒慻怐偑庢傝慻傫偱偄偄傞偑寛偟偰乵崻杮揑帯椕乶偲偄偆傛偆側尵梩偼巊偭偰偄側偄丅埨堈偵丄崱偼傗傝偺尵梩偱偄偆偲丄惙偭偰偄傞丄偺偱偼側偄偐丅崻杮揑丄偆偆乣傫丅
丂尰嵼椪彴帋尡拞偺懡偔偑丄姴嵶朎堏怉偺偨摢奧崪寠傪偁偗傞掕埵擼庤弍傪梫偡傞偺偵斾傋丄峈僀儞僼儖僄儞僓栻偺搳梌側傜偽揰揌惷拲偱偼側偄偐丅偦偺怤廝惈偼斾妑偵側傜側偄傎偳掅偄丅
丂乽楢実偱偒傞婇嬈條偱偛娭怱傪偍帩偪偄偨偩偗傞応崌偺楢棈偵偮偒傑偟偰偼丄壓婰偺栤偄崌傢偣愭偵偰彸傝傑偡丅乿偲偄偆婰弎傕偁傞丅
丂 楢実傪朷傓婇嬈偑嶦摓偡傞偼偢偩偲巚偆偺偩偑丄懕曬偑抦傝偨偄両両両
丂僾儗僗儕儕乕僗偺PDF僼傽僀儖偼偙偪傜偐傜丅
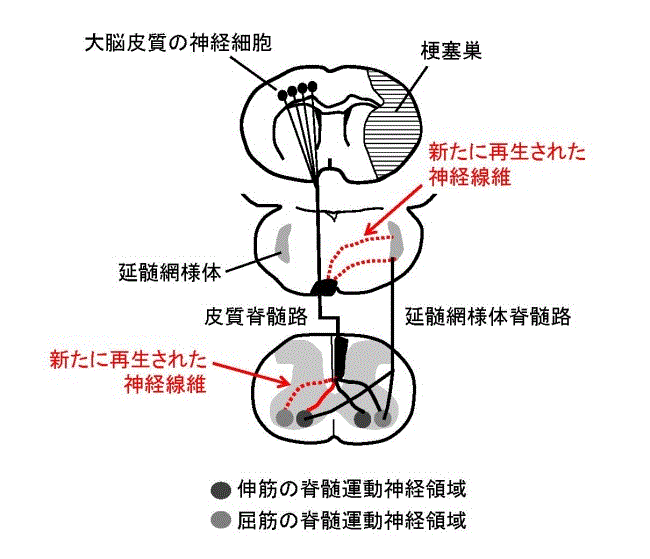
2024擭6寧2擔
丂惗棟妛尋媶強偺乽峈僀儞僼儖僄儞僓栻傪擼峓嵡偺嵞惗堛椕偵乿偲偄偆僞僀僩儖偺僾儗僗儕儕乕僗偑2024擭5寧24擔晅偗偱宖嵹偝傟偨丅 乽僲僀儔儈僯僟乕僛偺摥偒傪梷偊傞峈僀儞僼儖僄儞僓栻傪搳梌偡傞偙偲偵傛傝丄怴惗僯儏乕儘儞偺堏摦偍傛傃僯儏乕儘儞嵞惗偑懀恑偟丄擼彎奞偵傛偭偰幐傢傟偨擼婡擻偑夞暅偡傞偙偲傪柧傜偐偵偟傑偟偨丅乿偲偄偆丅
徻嵶偼偙偪傜偐傜丅
2023擭12寧10擔
丂杒奀摴戝妛昦堾偺2023/12/1晅偗偱乽枬惈婜擼弌寣姵幰傪懳徾偲偟偨帺壠崪悜姴嵶朎丒懌応嵽崌嵽偺擼撪堏怉朄 乮堛巘庡摫帯尡乯奐巒偺偍抦傜偣乿偲戣偡傞僯儏乕僗傪儕儕乕僗丅姴嵶朎偲懌応嵽傪慻傒崌傢偣偨惢昳乮HUFF-01乯傪擼撪偵捈愙搳梌偡傞偙偲偱杻醿側偳偺寉尭傪栚巜偟傑偡丄偲偁傞丅傑偨杒奀摴戝妛敪僗僞乕僩傾僢僾偺姅幃夛幮 RAINBOW 偍傛傃晉巑僼僀儖儉姅幃夛幮偺媄弍偑梡偄傜傟傞偲偺偙偲丅崱擭傕廔傢傠偆偲偄偆帪婜偵Good News両
20238寧7擔
怴妰戝妛擼尋媶強偺2023擭06寧20擔晅偗乽擼峓嵡偵懳偡傞丄僸僩枛徑寣扨妀媴傪梡偄偨怴偟偄嵶朎椕朄偺奐敪乿偲戣偡傞尋媶惉壥丒幚愌偺敪昞傪尒偮偗偨丅慺恖偺杔偵偼摉慠傛偔傢偐傜側偄偑丄側傫偲側偔棅傕偟偄帯椕朄偺傛偆側婥偑偡傞丅偤傂偛棗偔偩偝偄丅
2023擭5寧1擔
巆擮側僯儏乕僗丅嶰旽働儈僇儖僌儖乕僾偑丄寁夋傗慻怐偺恻梋嬋愜傪宱偰寢嬊丄Muse嵶朎傪梡偄偨嵞惗堛椕摍惢昳乮CL2020乯偺奐敪拞巭傪2023擭2寧14擔偵敪昞偟偨丅拞巭偺尨場偼柧傜偐偵偝傟偰偄側偄丅
崱屻偼丄Muse嵶朎偺巊梡偵娭偡傞尃棙偼嶰旽働儈僇儖僌儖乕僾偐傜弌郪嫵庼懁偵曉娨偝傟丄弌郪嫵庼偼怴偨偵僷乕僩僫乕婇嬈傪扵偡側偳偱奐敪傪懕偗傞曽恓偲偺偙偲丅弌郪嫵庼傜偼嶰旽働儈僇儖僌儖乕僾偺帯尡僨乕僞偵媈媊偑偁傞偲偟偰丄昦堾懁偺僇儖僥偲偺徠崌傪媮傔偰偄傞丅
2023擭寧16擔
杒奀摴戝妛偺僂僄僽僒僀僩偵2023擭2寧15擔偱乽怴婯奐敪偟偨僎儖傪梡偄偰擼偺恄宱慻怐偺嵞峔抸偵惉岟乿偲戣偡傞尋媶敪昞偑宖嵹偝傟偰偄偨丅
億僀儞僩偲偟偰師偺3揰偑嫇偘傜傟偰偄傞丗
仠恄宱姴嵶朎傪攟梴壜擻側僎儖偺嶌惢偵惉岟丅
仠儅僂僗偺擼撪偵僎儖傪杽傔崬傒丄偦偺屻恄宱姴嵶朎傪拲擖偡傞偙偲偱擼慻怐傪憂弌丅
仠彨棃偺擼懝彎帯椕傊宷偑傞婎慴媄弍偲側傞偙偲傪婜懸丅
傑偩儅僂僗偺抜奒偩偑偝傜側傞尋媶僼僃乕僘傊偺恑揥偑朷傑傟傞丅
2022擭9寧29擔
NHK NEWS WEB偺2022擭9寧7擔晅偗偺乽擼峓嵡偱懝彎丂恄宱嵶朎偺嵞惗傪栚巜偡椪彴尋媶丂峀搰戝妛乿偲戣偡傞婰帠偵拲栚丅
擼峓嵡偵傛偭偰懝彎偟偨恄宱嵶朎偺嵞惗傪栚巜偟偰丄峀搰戝妛偺尋媶僌儖乕僾偼丄姵幰偺摢奧崪偐傜庢偭偨摿庩側嵶朎乮娫梩宯姴嵶朎乯傪攟梴偟丄偦偺姵幰偵搳梌偡傞椪彴尋媶傪奐巒偟偨偲偺偙偲丅搳梌曽朄偼揰揌偩偐傜怤廝惈偼掅偄丅
摢奧崪偐傜庢傝弌偟偨摿庩側嵶朎傪攟梴偟偰栠偡偲偄偆帯椕偼悽奅弶丅姵幰帺恎偺嵶朎偺偨傔嫅愨斀墳側偳偼彮側偄偲偄偆丅棃擭枛傑偱偵俇恖偺姵幰傪懳徾偵幚巤偡傞偲偟偰偄傞丅媣乆偺慺惏傜偟偄僯儏乕僗偩丅
2022擭3寧16擔
埲慜2搙偽偐傝徯夘偟偨恄宱嵞惗懀恑暔幙LOTUS偵娭偡傞尋媶曬崘偑偁偭偨丅乽恄宱嵞惗懀恑暔幙LOTUS偺堚揱巕摫擖偵傛傝愐悜懝彎偵懳偡傞僸僩iPS嵶朎桼棃恄宱姴嵶朎堏怉帯椕偺岠壥傪夵慞乿偲戣偡傞婰帠偱擼峓嵡偵傕怗傟偰偄傞丅
2021擭12寧25擔
嶰旽働儈僇儖儂乕儖僨傿儞僌(慜偼惗柦壢妛僀儞僗僥傿僥儏乕僩偲偟偰敪昞)偼乽Muse嵶朎傪梡偄偨嵞惗堛椕摍惢昳乮CL2020乯偺奐敪偵偮偄偰乿偲偄偆婰帠傪2021/12/15偵峏怴偟偨丅庡梫偼峏怴撪梕偼乭乽忦審媦傃婜尷晅彸擣乿偱偼側偔丄捈愙乽杮彸擣乿偺庢摼傪栚巜偡偙偲偲抳偟傑偟偨丅乭偲偄偆棅傕偟偄傕偺丅徻嵶偼摨幮偺僂僃僽僒僀僩傪嶲徠偟偰偔偩偝偄丅
2021擭10寧30擔
CD34梲惈嵶朎
2021/09/02晅偗偺撉攧怴暦僆儞儔僀儞僐儔儉偵乽枬惈擼峓嵡偺姵幰偺婡擻夞暅偵婜懸丄寣娗傪嵞惗偡傞嵶朎搳梌乧帯尡奐巒乿偲偄偆婰帠偑偁偭偨丅 寣塼偐傜寣塼惉暘暘棧憰抲偱拪弌偟偨乽CD34梲惈嵶朎乿傪巊偭偰帯尡傪奐巒偟偨偲偄偆丅CD34梲惈嵶朎偼庱偺摦柆偐傜擼撪偵搳梌偡傞丅拲栚偡傋偒撪梕偩丅枬惈擼峓嵡偺姵幰16恖偱8恖偼搳梌丄8恖偼搳梌偟側偄偲偱斾妑偡傞偲偄偆丅側傫偲7寧偵侾椺栚傪幚巤偟偨偲偁傞丅嵶朎偺拪弌傗搳梌偺怤廝惈偺揰偱桪傟偰偄傞丅庱偺摦柆偲偄偆偺偑慺恖偵偼偪偭偲偽偐傝婥偵側傞偑惷柆搳梌傛傝擼偵摓払偟傗偡偄偺偐側偲傕巚偆丅壗傛傝傕懳徾偑枬惈婜擼峓嵡側偺偑棅傕偟偄丅傑偨慖戰巿偑憹偊偨丅傛偄寢壥偑弌傞偙偲傪婜懸偟偨偄両
2021擭10寧23擔
iSC嵶朎偲LOTUS
擇偮偲傕2017擭崰榖戣偵側偭偨偒傝偦偺屻恑捇忣曬偑尒偮偐傜側偄丅僐儘僫壭偑彮側偐傜偢塭嬁偟偰偄傞偲巚傢傟傞丅偙偙偱偍偝傜偄偺堄枴偱傕偆堦搙師偺Web僒僀僩傪徯夘偡傞丅
iSC嵶朎
LOTUS
iSC嵶朎側偳偼偁傞僥儗價斣慻偱乽僲乕儀儖徿媺乿側偳偲尵傢傟偨丅LOTUS偼乽嬤偄彨棃丄惛惢LOTUS 僞儞僷僋幙傪懱偺奜偐傜搳梌偡傞栻暔帯椕傗丄LOTUS 傪堚揱巕摫擖偡傞堚揱巕帯椕側偳偺恄宱嵞惗堛椕媄弍偵敪揥偡傞偙偲偑婜懸偝傟傑偡丅乿偲偄偆婰弎傗壓偺恾偐傜杔偼戝偄偵婜懸偟偰偄傞丅偲偄偆偺傕杔偼墑悜偺忋埵塣摦僯儏乕儘儞偺懝彎偱惗偠傞廳搙偺壖惈媴杻醿傪姵偭偰偍傝偙傟偼廳搙偺殝壓忈奞偲峔壒忈奞傪掓偡傞偐傜偩丅慺恖峫偊偱尒摉堘偄偐傕偟傟側偄偑......丅
偄偢傟偵偟偰傕憗偄恑捇偑朷傑傟傞......
2021擭9寧26擔
嵟嬤Muse嵶朎偺慺惏傜偟偄帯尡偺寢壥偑暥弔僆儞儔僀儞傗YouTube側偳偱傕庢傝忋偘傜傟偰偄傞偑丄敪徢屻14乣28擔偲偄偭偨婎弨傪枮偨偟偨35恖傪懳徾偲偟偨擇廳栍専斾妑帋尡偱偁傞丅敪徢偐傜椺偊偽4擭傪宱偨枬惈婜擼峓嵡姵幰偵傕桳岠偐偳偆偐傪偤傂帯尡傪峴偭偰梸偟偄丅偲偄偆偺偼嵶朎偑彎奞晹埵偵梀憱偡傞偺偼彎奞晹埵偐傜敪偣傜傟SOS僔僌僫儖偵摫偐傟傞偲偄偆偑丄敪徢偐傜4擭屻傕僔僌僫儖偑敪偣傜傟傞偺偐丅偦傟偲惷柆搳梌偩偐傜怤廝惈偺柺偱桪傟偰偄傞偑BBB乮寣塼娭栧乯傪捠夁偱偒傞偺偐側偳丄峓嵡晹埵傊偺嵶朎偺惗拝偵娭偟偰慺恖側傝偵摎偊偺抦傝偨偄慺杙側媈栤偑巆傞丅憗偗傟偽丄崱擭拞偵怽惪丄棃擭搙偵惢昳壔偲偁傞丅傕偪傠傫惢昳壔偝傟偨傜懍峌偱帯椕傪庴偗偨偄丅惢昳壔偝傟偨偲偒偵柧帵揑偵媫惈婜偲偐夞暅婜偲偐偵惂尷帠崁偑帵偝傟偰偄傟偽暿偩偑丅偄偢傟偵偟偰傕憗偄惢昳壔偑朷傑傟傞丅
2021擭7寧21擔
嬼慠2021擭6寧11擔晅偗偺僙儖僜乕僗幮偺乽弴揤摪戝妛偲僙儖僜乕僗丄僄僋僜僜乕儉傪梡偄偨擼峓嵡屻堚徢丒僷乕僉儞僜儞昦偺帯椕偵偮偄偰嫟摨尋媶傪幚巤乿偲戣偡傞僾儗僗儕儕乕僗偵弌夛偭偨丅
僄僋僜僜乕儉偲偄偆偺偼弶帹偩丅娫梩宯姴嵶朎桼棃偺嵶朎暘斿彫朎偲偺偙偲傜偟偄偑慺恖偺巹偵偼傛偔傢偐傜側偄丅僱僢僩偱専嶕偡傞偲偄偔偮偐偺尋媶偑偁傝丄偦傟偧傟偑偩偄傇恑傫偱偄傞丅娫梩宯姴嵶朎偺堏怉偵傛傞擼偺嵞惗堛椕偼峀偔尋媶偝傟偰偄傞偺偼廃抦偩丅僄僋僜僜乕儉偼娫梩宯姴嵶朎偑暘斿偡傞丅偦偺暘斿暔偩偗傪梡偄偨帯椕偐側丅 偄偢傟偵偟偰傕慖戰巿偑憹偊傞偺偼椙偄偙偲偩丅崱屻丄僄僋僜僜乕儉偲偄偆僉乕儚乕僪傪捛愓偟偰偄偙偆偲巚偆丅
2021擭6寧16擔
2021擭5寧18擔晅偗偱姅幃夛幮惗柦壢妛僀儞僗僥傿僥儏乕僩偑乽擼峓嵡姵幰傪懳徾偲偟偨Muse嵶朎惢昳CL2020偺椪彴帋尡寢壥偵娭偡傞敪昞偵偮偄偰乿偲戣偡傞僪僉儏儊儞僩傪搳峞偟偨丅CL2020偼惷柆搳梌偩偐傜怤廝惈偺揰偱桪傟偰偄傞偑偙偺椪彴帋尡偼媫惈婜擼峓嵡偑懳徾偩丅偤傂枬惈婜擼峓嵡偵懳偡傞岠壥偺椪彴帋尡傪偟偰梸偟偄丅侾擭傎偳慜偺儔僢僩偱偺帋尡寢壥偱CL2020偺姵晹偵梀憱偡傞儂乕儈儞僌偲枬惈婜擼峓嵡偵懳偡傞岠壥偺偮偄偰怗傟偰傞偑傗偼傝儔僢僩偩偐傜丅僸僩偱枬惈婜偵惷柆搳梌偟偨CL2020偑姵晹偵梀憱偡傞偐偳偆偐偤傂抦傝偨偄丅捈愙搳梌乮擼偺掕埵庤弍乯偼偳偆偟偰傕晄埨偑偁傞.....
2021擭1寧14擔
2019擭12寧3擔晅偗偱乽擼峓嵡偺嵞惗堛椕傊岦偗偰杒戝弝嫵庼傜偑儀儞僠儍乕愝棫乿偲偍抦傜偣偟傑偟偨偑丄偄傛偄傛乽姅幃夛幮RAINBOW乿偲偟偰Web僒僀僩傪岞奐偟傑偟偨丅戞2憡帯尡偱偼乽枬惈婜擼峓嵡乿傪僞乕僎僢僩偲偡傞偙偲偑柧婰偝傟偰偄傑偡丅丂婜懸偟傑偟傚偆両両両
2020擭12寧9擔
2019擭2寧9擔偵乽僀僊儕僗偺ReNeuron幮偺CTX僸僩戀帣桼棃姴嵶朎偵傛傞帯尡寢壥偺梫巪偑擼恄宱奜壢堛愳杧 恀恖巵偺WEB僒僀僩偱徯夘偝傟偰偄傑偡丅
偙偙偵徯夘偝傟偰偄傞偺偼Phase I (PISCES)偺寢壥偱偡丅Phase
IIa(PISCES-II)傕偡偱偵幚巤偝傟椙岲側寢壥偑摼傜傟偨偨傔丄暷崙偱柍嶌堊僾儔僙儃懳徠帯尡Phase IIb(PISCES
III)傪奐巒偡傞偙偲偑FDA偵傛偭偰擣壜偝傟傑偟偨丅偍傛偦110恖傪懳徾偵峴傢傟傞梊掕偱尰嵼旐尡幰傪曞廤拞偱偡丅乿偲偄偆忣曬傪偍揱偊偟傑偟偨偑丄僐儘僫壭偺塭嬁傪庴偗偰偄側偄偐婥偵側傝ReNeuron幮偺僒僀僩傪墈棗偟偨偲偙傠師偺傛偆側婰帠偑偁傝傑偟偨丗
As a result of the positive data
from the PISCES II study, the FDA approved the commencement of a randomised,
placebo-controlled, Phase IIb clinical trial in the US in patients living with
chronic stroke disability (PISCES III). This trial is underway, with plans to
enrol approximately 130 patients across up to 40 centres in the US, but is
currently on hold due to Covid-19 related restrictions. and will remain
suspended in the US for the foreseeable future.
Following a review of
programme priorities, this trial will remain suspended in the US for the
foreseeable future; clinical trial sites will be kept open and patients already
treated will be followed up over time in line with the clinical trial protocol.
The Company乫s stroke disability programme with its CTX cell therapy
candidate will continue through regional partnerships. ReNeuron乫s exclusive
licensing partner in China, Shanghai Fosun Pharmaceutical Industrial Development
Co., Ltd. (乬Fosun Pharma乭), will develop the Company乫s CTX cell therapy
candidate for stroke disability in the licensed territory (Greater China
including Hong Kong, Macao and Taiwan) where the Company has the potential to
benefit from future operational and regulatory milestones under this out-license
agreement. Clinical trial applications have recently been filed by Fosun Pharma
to open clinical sites in the licensed territory to build on the clinical data
already generated in the US.
The primary efficacy objective for PISCES
III is to assess the effect of CTX drug product on the change in degree of
dependency and disability from baseline as measured by the modified Rankin Scale
(mRS) at 6 months post-treatment. The mRS is a well-established, 7-point,
clinician-reported global measure of functional disability in patients and of
their dependence upon others in carrying out activities of daily living. A 1
point improvement from baseline on the mRS is considered clinically meaningful
as it represents a stroke patient乫s ability to function more independently.
The target population for PISCES III is patients, who have stabilised
following an ischemic stroke 6-24 months prior to treatment, with moderate to
moderately severe functional disability requiring help from others to carry out
activities of daily living or to ambulate.
[translated by DeepL]
PISCES
II帋尡偱摼傜傟偨椙岲側僨乕僞偺寢壥丄FDA偼枬惈擼懖拞忈奞幰傪懳徾偲偟偨柍嶌堊壔僾儔僙儃懳徠戞嘦b憡椪彴帋尡乮PISCES
III乯偺暷崙偱偺奐巒傪彸擣偟傑偟偨丅
偙偺帋尡偼尰嵼恑峴拞偱丄暷崙偺嵟戝40巤愝偱栺130柤偺姵幰偝傫傪搊榐偡傞寁夋偱偡偑丄Covid-19偵娭楢偟偨惂尷偺偨傔丄尰嵼偼曐棷拞偱偡丅
僾儘僌儔儉偺桪愭弴埵偺尒捈偟傪峴偭偨寢壥丄杮帋尡偼摉柺偺娫丄暷崙偱偺幚巤偼拞巭偝傟傑偡丅
CTX嵶朎椕朄岓曗昳傪梡偄偨摉幮偺擼懖拞忈奞僾儘僌儔儉偼丄抧堟偺僷乕僩僫乕僔僢僾傪捠偠偰宲懕偟偰偄偒傑偡丅儕乕僯儏乕儘儞偺拞崙偵偍偗傞撈愯揑儔僀僙儞僗僷乕僩僫乕偱偁傞忋奀樑嶳惢栻岺嬈敪揥桳尷岞巌乮埲壓乽樑嶳惢栻乿偲偄偄傑偡丅Ltd.乮埲壓乽樑弴惢栻乿乯偼丄摉幮偺擼懖拞忈奞偵懳偡傞CTX嵶朎椕朄岓曗傪丄儔僀僙儞僗抧堟乮崄峘丄儅僇僆丄戜榩傪娷傓戝拞壺寳乯偱奐敪偡傞梊掕偱偡丅
僼僅僗儞僼傽乕儅偼丄暷崙偱婛偵摼傜傟偨椪彴僨乕僞傪傕偲偵丄儔僀僙儞僗抧堟偱偺椪彴帋尡傪奐巒偡傞偨傔偺怽惪傪嵟嬤峴偭偰偄傑偡丅
PISCES
III偺庡側桳岠惈偺栚揑偼丄CTX惢嵻偑搳梌6儠寧屻偺儀乕僗儔僀儞偐傜偺埶懚搙偲忈奞偺掱搙偺曄壔乮modified Rankin
Scale乮mRS乯偱應掕乯偵媦傏偡塭嬁傪昡壙偡傞偙偲偱偡丅
mRS偼丄姵幰偝傫偺婡擻忈奞偍傛傃擔忢惗妶摦嶌傪峴偆忋偱偺懠幰傊偺埶懚搙傪帵偡丄妋棫偝傟偨7崁栚偺椪彴壠曬崘偵傛傞僌儘乕僶儖側広搙偱偡丅mRS偱儀乕僗儔僀儞偐傜1億僀儞僩偺夵慞偼丄擼懖拞姵幰偺帺棫偟偨婡擻傪帵偡傕偺偱偁傝丄椪彴揑偵堄枴偺偁傞傕偺偲峫偊傜傟偰
慜夞PISCES III偺懳徾幰偼丄帯椕偺6乣24儢寧慜偵嫊寣惈擼懖拞傪敪徢偟偰埨掕偟丄擔忢惗妶摦嶌傗曕峴偵懠幰偺彆偗傪昁梫偲偡傞拞摍搙乣拞摍搙偺婡擻忈奞傪桳偡傞姵幰偝傫偱偡丅
傗偼傝僐儘僫壭偺塭嬁偱曐棷偵側偭偰偄傑偟偨丅偟偐偟拞崙偱偼幚巤偝傟傞傛偆偱偡偺偱婜懸偟傑偟傚偆.....??
2020擭10寧30擔
慜夞儈僋儘僌儕傾偺壜擻惈偵偮偄偰徯夘偟偨偑偦傟傪曗堚偡傞抁偔傑偲傔傜傟偨婰帠偑栻帠擔曬偺Web僒僀僩偵偵宖嵹偝傟偰偄偨偺偱偙偙偵堷梡偡傞丅
儈僋儘僌儕傾偵傛傞帯椕偵婜懸 栻帠擔曬
2017擭02寧27擔 (寧)
仧擼偺柶塽嵶朎偱偁傞儈僋儘僌儕傾傊偺娙扨側巋寖偑擼峓嵡偺夋婜揑側帯椕偵偮側偑傞壜擻惈偑丄怴妰戝妛擼尋媶強恄宱撪壢偺壓敤嫕椙弝嫵庼傜偲崙棫昦堾婡峔怴妰昦堾偺嫟摨尋媶偵傛偭偰悽奅偱弶傔偰柧傜偐偵偝傟偨
仧娙扨側巋寖偲偼丄栻嵻傪巊傢偢偵儈僋儘僌儕傾傪巁慺偲僽僪僂摐擹搙偑掅壓偟偨擼峓嵡偵椶帡偟偨娐嫬偵抁帪娫敇業偝偣傞偲偄偆傕偺
仧偙偺尋媶偵傛傝丄儈僋儘僌儕傾嵶朎偵偙偺傛偆側娙扨側巋寖傪偆偙偲偱丄擼曐岇揑偵嶌梡偡傞慞嬍偺M2儈僋儘僌儕傾嵶朎偵曄壔偱偒傞偙偲丄側傜傃偵偙偺嵶朎傪媫惈婜帯椕偑偱偒偢偵屻堚徢偑巆偭偨擼峓嵡姵幰偵堏怉偡傟偽丄婡擻夞暅偑懀恑偝傟傞壜擻惈偑柧傜偐偵側偭偨
仧偙偺儈僋儘僌儕傾偵傛傞帯椕偑幚梡壔偝傟傟偽丄枬惈婜偺婡擻夞暅偲偟偰弶傔偰偺夋婜揑側撪壢揑帯椕朄偲側傞丅壛偊偰丄斾妑揑娙扨側庤朄偱儈僋儘僌儕傾偺M2壔偑壜擻側偨傔丄愱栧揑側嵶朎挷惍僙儞僞乕傪帩偨側偄堦斒昦堾偵偍偗傞帯椕偺晛媦偵偮側偑傞偙偲偑婜懸偱偒傞丅崱屻偺尋媶摦岦偵拲栚偟偨偄丅
儈僋儘僌儕傾偺壜擻惈偵偄偰偼丄2017擭偵曬偠傜傟偨偐傜姵幰偺扤傕偑崱尰嵼偺恑捇忬嫷傪抦傝偨偄偲婅偭偰偄傞偩傠偆丅偙偺婰帠傪撉傔偽偦偺巚偄偑堦憌崅傑傞丅僐儘僫壭偺塭嬁傪庴偗偰偄側偗傟偽傛偄偺偩偑丄柍棟偐側.....
2020擭8寧13擔
傕偆堦偮偺壜擻惈
2019/11/19晅偗擔杮宱嵪怴暦揹巕斉偺婰帠傛傝
乽怴妰戝妛側偳 擼峓嵡偺徢忬夞暅
掅僐僗僩偱怴庤朄
怴妰戝妛側偳偺尋媶僌儖乕僾偼丄擼峓嵡偺徢忬傪夞暅偝偣傞怴庤朄傪儔僢僩傪巊偭偨幚
尡偱敪尒偟偨丅寣塼拞偺敀寣媴撪偺嵶朎偺堦庬傪庢傝弌偟丄巁慺傗僽僪僂摐偺擹搙傪堦 掕帪娫掅壓偝偣偨娐嫬偵抲偄偰偐傜搳梌偡傞偲丄慻怐偺廋暅傗屻堚徢偺夵慞偑尒傜傟
偨丅掅僐僗僩側擼峓嵡偺帯椕朄偺奐敪偵栶棫偮偲傒偰偍傝丄2乣3擭屻偺椪彴墳梡傪栚巜偡丅
怴妰戝偺敥嶳岞戝摿擟彆嫵傗嬥戲夒弝嫵庼傜偑丄婒婒晫戝妛側偳偲尋媶偵庢傝慻傫偩丅 尋媶僌儖乕僾偼乽扨妀媴乿偲屇傇敀寣媴撪偺嵶朎偵拝栚丅巁慺偲僽僪僂摐偺擹搙傪18帪
娫丄壓偘偨忬懺偵抲偄偨扨妀媴傪丄擼峓嵡偺儔僢僩偵搳梌偡傞偲丄擼偺寣娗傗恄宱嵶朎偺廋暅偑婲偒偨丅乿
嵶朎偺堦庬偲偄偆偺偼儈僋儘僌儕傾偺偙偲偱丄儈僋儘僌儕傾傪擼峓嵡偵椶帡偟偨娐嫬乮偡側傢偪巁慺偲僽僪僂摐偺擹搙偑掅壓偟偨忬嫷乯偵抁帪娫敇業偝偣傞偲偄偆娙扨側巋寖偵傛傝丆儈僋儘僌儕傾偺帩偮丄慻怐傪廋暅偡傞擻椡傪妶惈壔偡傞偲偄偆偺偩丅徻嵶偼偙偪傜偐傜丅偙傟偼枬惈婜擼峓嵡傕婜懸偱偒偦偆側偺偱丄2021擭枛乣2022擭枛偺椪彴墳梡偑妝偟傒偩丅
2020擭4寧23擔
Muse嵶朎偺椪彴帋尡偺寢壥
杮擔晅偗偱惗柦壢妛僀儞僗僥傿僥儏乕僩偼丄乽擼峓嵡姵幰傪懳徾偲偟偨 Muse
嵶朎惢昳乮CL2020乯偺椪彴帋尡偺寢壥偵娭偡傞偍抦傜偣乿偲戣偡傞僾儗僗儕儕乕僗傪敪昞偟偨丅懳徾偼枬惈婜偱偼側偔垷媫惈婜擼峓嵡偩偑偆傟偟偄僯儏乕僗偱偁傞偙偲偵堘偄偼側偄丅拝幚偵恑傫偱偄傞丅戝偄偵桬婥晅偗傜傟傞丅偟偮偙偄傛偆偩偑丄媣乆偺偆傟偟偄僯儏乕僗偩丅
2020擭1寧16擔
Muse嵶朎偵偮偄偰傑偲傔偰傒偨
丒Muse嵶朎偲偼
惗柦壢妛僀儞僗僥傿僥儏乕僩偺僾儗僗儕儕乕僗偐傜堷梡
乽Muse 嵶朎乮Multilineage-differentiating Stress Enduring cell乯偼丄2010
擭偵搶杒戝妛偺弌郪棟嫵庼傜偺僌儖乕僾偵傛傝敪尒偝傟偨丄僸僩偺懡條側嵶朎偵暘壔偡傞擻椡傪桳偡傞懡擻惈姴嵶朎偱偡丅傕偲傕偲惗懱撪偺娫梩宯慻怐撪偵懚嵼偡傞帺慠偺姴嵶朎偱偁傞偙偲偐傜庮釃壔偺寽擮偑彮側偄偙偲偵壛偊丄栚揑偲偡傞嵶朎偵暘壔桿摫偡傞昁梫偑側偔丄偦偺傑傑惷柆撪偵搳梌偡傞偩偗偱彎奞晹埵偵梀憱丄廤愊偟丄惗拝偟偰慻怐傪廋暅偡傞偲偄偆摿挿傪桳偟偰偄傑偡丅乿
丒惗柦壢妛僀儞僗僥傿僥儏乕僩偲搶杒戝妛傗婒晫戝妛偺嫟摨偱峴傢傟偰偄傞椪彴帋尡
| 懳徾幘姵 | 奐巒擭寧 | 僾儗僗儕儕乕僗 |
| 媫惈怱嬝峓嵡 | 2018擭1寧 |
|
| 擼峓嵡 | 2018擭9寧 |
|
| 昞旂悈醰徢 | 2018擭12寧 |
|
| 愐捙懝彎 | 2019擭7寧 |
|
丒栚昗
惗柦壢妛僀儞僗僥傿僥儏乕僩偼4偮偺偄偢傟偐偺幘姵偱2020擭搙偺彸擣怽惪偲2021擭搙偺彸擣傪栚巜偡偲偄偆丅
2019擭12寧3擔
擼峓嵡偺嵞惗堛椕傊岦偗偰杒戝弝嫵庼傜偑儀儞僠儍乕愝棫
擼峓嵡偺姵幰偺擼偵杮恖偺崪悜偐傜嵦庢丄攟梴偟偨姴嵶朎乮帺壠嵶朎乯傪捈愙搳梌偡傞怴偨側嵞惗堛椕偺幚尰傪栚巜偡儀儞僠儍乕婇嬈乮RAINBOW乯傪丄杒戝昦堾擼恄宱奜壢偺愳杧恀恖摿擟弝嫵庼傜偑愝棫偟偨丅僒儞僶僀僆偺嵞惗嵶朎栻SB623偼懠壠桼棃偺娫梩宯姴嵶朎偱偁傞揰偱偙傟偲堎側傞偑丄捈愙搳梌偱偁傞揰偱偼摨偠偱偁傞丅僾儗僗儕儕乕僗偵傛傞偲尰嵼峴偭偰偄傞擼峓嵡垷媫惈婜帯椕偺帯尡傪捠偠偰埨慡惈傗岠壥傪妋擣偟偰丄2023擭偐傜悢廫恖婯柾偺擼峓嵡枬惈婜偵懳偡傞帯尡偺梊掕丅徻嵶側帯尡傪宱偰2026擭偺帠嬈壔傪栚巜偡偲偺偙偲丅擼峓嵡枬惈婜偵懳偡傞帯尡偑峴傢傟傞偙偲偵婜懸偡傞丅2026擭偐乧77嵨偵側傞乧偲偵偐偔儕僴價儕婃挘偭偰偦偺擔偵旛偊偰偍偔偟偐側偄丅
2019擭7寧1擔
iSC嵶朎
iSC嵶朎偵偮偄偰偼埲慜丄恄屗怴暦偺婰帠傪徯夘偟偨偑偦偺屻怴偟偄僯儏乕僗偑側偄偐挷傋偰傒偨丅暫屔堛壢戝丄徏嶳巵偺嵟廔島媊偱iSC嵶朎偵尵媦偝傟偰偄傞懠偵塇捁怲堦儌乕僯儞僌僔儑乕偺2017擭1寧6擔曻憲暘偱乽擼峓嵡偺帯椕亀掕愢暍偡敪尒亁乿偲偟偰庢傝忋偘傜傟偰偄偨偙偲偑暘偐偭偨丅
敳悎丗
嬍愳乮偙偺恖偐側傝柺敀偄恖偱丄偦偺儐僯乕僋偱揑妋側僐儊儞僩偑慺惏傜偟偄乯丗乽徏嶳愭惗偵傛傞偲丄亀栤戣側偺偼偍嬥偑側偄偙偲丄傗傝偨偄傫偩偗偳偱偒側偄傫偩亁偲丄揹榖偱偍偭偟傖偭偰偄傑偟偨乿
塇捁丗乽悽婭偺敪尒丄偲偄偆偙偲偱偄偄傢偗偱偡偹乿
嬍愳丗乽尵偭偰偄偄傫偠傖側偄偱偟傚偆偐偹偊乿
乽傕偟偐偟偰僲乕儀儖徿媺偺戝敪尒乿偑帒嬥柺偺忈奞偑偁偭偰偼側傜側偄偲巚偆偺偩偑丅
2019擭6寧30擔
嵞惗堛椕偱偼側偄偑嫽枴怺偄婰帠偑偁偭偨偺偱徯夘偟傑偡丅
乽擼峓嵡枬惈婜偵偍偄偰恄宱徢忬傪夞暅偝偣傞怴婯擼撪T嵶朎傪敪尒乗峈偆偮嵻偑惂屼惈T嵶朎傪憹傗偟擼峓嵡偺徢忬傪娚榓乗乿偲偄偆僾儗僗儕儕乕僗偑栚傪堷偄偨丅
儅僂僗儌僨儖傪梡偄偨幚尡偵傛傝丄擼峓嵡屻偺枬惈婜偵怴偨偵敪尒偝傟偨柶塽嵶朎偑摥偒丄恄宱徢忬偺夞暅偵婑梌偡傞偙偲傪敪尒偟偨偲偄偆丅婛偵峈偆偮嵻偲偟偰巊梡偝傟偰偄傞僙儘僩僯儞傪憹傗偡栻偑T儗僌傪偝傜偵憹傗偟擼峓嵡偵傛傞恄宱徢忬傪娚榓偟偨偲偄偆偺偩丅
擼峓嵡嵞敪屻偼峈偆偮嵻偑3庬椶張曽偝傟偰偄偨丅栻捫偗偵側傞偺偼寵側偺偱偟偽傜偔偟偰偐傜扴摉堛偲憡択偟偰彊乆偵尭傜偟偰崱偼儗僋僒僾儘忶10mg偩偗傪堸傫偱偄傞乮暡嵱偟偰悈偵梟偐偟偰偐傜僔儕儞僕偱宱娗搳梌乯丅岾偄儗僋僒僾儘偼擼撪偺僙儘僩僯儞傪憹傗偡僞僀僾偺峈偆偮嵻偱丄偙偺僾儗僗儕儕乕僗偱尵媦偝傟偰偄傞峈偆偮嵻偵奩摉偡傞丅枬惈帪偵傎傫偺嬐偐偩偑塣摦婡擻偺夵慞偑偁傞偺偼丄偙偺栻偑婑梌偟偰偄傞偺偐側乧峈偆偮嵻偼巭傔偨偐偭偨偑丄1庬椶偩偗巆偟偰偍偄偰椙偐偭偨偲偄偆偙偲偐側乧
2019擭6寧13擔
怴妰戝妛偺尋媶惉壥丒幚愌儁乕僕偵2017擭2寧9擔晅偗偱乽擼峓嵡偵懳偡傞擼偺柶塽嵶朎儈僋儘僌儕傾傪梡偄偨怴偟偄嵶朎椕朄偺惉岟乿偲偄偆婰帠偑敪昞偝傟偰偄傑偟偨丅懠偵偵傕WEB忋偵儈僋儘僌儕傾傪梡偄偨帯椕偺愽嵼惈傪帵偡婰帠偑偁傝丄偦傟傜傪梫栺偡傞偲丄擼偺柶塽嵶朎偱偁傞儈僋儘僌儕傾傪M2壔偟搳梌偡傞偙偲偱丄恄宱曄惈幘姵丏懡敪惈峝壔徢丏擼峓嵡丏僂僀儖僗姶愼丏擼庮釃丏惛恄幘姵偵偍偄偰丏懝彎偟偨拞悤恄宱宯慻怐偺廋暅傗惓忢壔偵栶棫偮壜擻惈偑崅偔丏怴偨側憂栻僞乕僎僢僩偲側傝偊傞偲偄偆丅摿偵怴妰戝妛偺僪僉儏儊儞僩偱偼枬惈婜擼峓嵡偵懳偡傞岠壥偵尵媦偟偰偄傞偺偑偆傟偟偄丅
徻嵶偼丗http://www.bri.niigata-u.ac.jp/result/docs/270214pressrelease.pdf
怴妰戝妛擼尋媶強偺尋媶惉壥丒幚愌儁乕僕丗http://www.bri.niigata-u.ac.jp/result/index.html
2019擭6寧9擔
2019擭6寧6擔丄晉巑僼僀儖儉晉嶳壔妛姅幃夛幮偼擼懖拞屻偺儕僴價儕僥乕僔儑儞岠壥傪懀恑偡傞怴栻岓曗壔崌暔乽T-817MA乿偺椪彴戞俀憡帋尡傪奐巒偟偨偙偲傪敪昞偟偨丅擼懖拞屻偺夞暅婜儕僴價儕僥乕僔儑儞偵偍偄偰丄塣摦婡擻夞暅偺懀恑岠壥側偳傪妋擣偡傞偲偟偰偄傞丅
徻嵶偼丗http://fftc.fujifilm.co.jp/information/detail/190606.html
2019擭5寧19擔
Muse嵶朎偵娭偟偰傕偆傂偲偮摿嫋偑乽敪柧偺柤徧丗懡擻惈姴嵶朎傪懝彎晹埵偵桿摫偡傞梀憱場巕傪娷傓堛栻慻惉暔乿偲偟偰崙嵺弌婅偝傟偰偄傞丅懝彎晹埵偵桿摫偡傞梀憱場巕傪娷傓偲偄偆婰弎偑拲栚偝傟傞丅
徻嵶偼丗WO2014133170A1
2019擭5寧6擔
2019/01/12偵丄僯僾儘偑嶥杫堛戝偲嫟摨偱奐敪偟偨愐悜懝彎傪懳徾偲偡傞嵞惗堛椕栻STR01(帺屓崪悜娫梩宯姴嵶朎丗僗僥儈儔僢僋)偵偮偄偰丄岤惗楯摥徣傛傝乽忦審媦傃婜尷晅彸擣乿傪庢摼偟偨偙偲傪儗億乕僩偟偨偑丄憗乆偵栻壙廂嵹偑椆彸偝傟偨丅1夞搳梌偺嶼掕栻壙偼1495枩7755墌偲偺偙偲丅3妱晧扴偺応崌4,487,327墌丅1妱偱1,495,776墌丅彨棃擼峓嵡懳徾偱彸擣偝傟偨応崌偱傕栻偼摨偠偩偐傜栻壙傕摨偠偵側傞偩傠偆丅僒儞僶僀僆偺SB623傕奜彎惈擼懝彎懳徾偱摨條偺彸擣傪嬤偄偆偪偵摼傜傟傞偩傠偆偑丄懠壠桼棃偺偨傔栻壙偼僗僥儈儔僢僋傛傝傕偩偄傇壓夞傞偲梊憐偝傟傞丅
2019擭4寧22擔
Muse嵶朎(Multilineage-differentiating Stress Enduring Cell)偺擼峓嵡傪懳徾偲偟偨扵嶕揑椪彴帋尡偼2018擭9寧偐傜搶杒戝妛昦堾偱奐巒偝傟偰偄傞偑丄婜懸傪崬傔偰偙偙偱Muse嵶朎偵偮偄偰偺忣曬傪娙扨偵傑偲傔偰傒偨丅
崙嵺岞奐擔丗2012擭10寧4擔乮04.10.2012)
崙嵺岞奐斣崋丗WO2012133948A1
椪彴帋尡偼傑偢垷媫惈婜偺擼峓嵡姵偵懳偟偰峴傢傟傞丅Muse 嵶朎惢昳偑堛栻昳偲偟偰忋巗偝傟偨応崌丄揔墳徢偲偟偰枬惈婜擼峓嵡偑娷傑傟傞偐偳偆偐偼傢偐傜側偄偑椪彴帋尡偑奐巒偝傟偨偙偲偼擼峓嵡姵偺廳搙屻堚徢偵嬯偟傫偱偄傞恖乆偵戝偒側婓朷傪梌偊偰偔傟傞丅偱偒傟偽栻昳搳梌偲儕僴價儕傪僙僢僩偵偟偰梸偟偄丅
2019擭2寧6擔
僀僊儕僗偺ReNeuron幮偺CTX僸僩戀帣桼棃姴嵶朎偵傛傞帯尡寢壥偺梫巪偑擼恄宱奜壢堛愳杧 恀恖巵偺WEB僒僀僩偱徯夘偝傟偰偄傑偡丅
偙偙偵徯夘偝傟偰偄傞偺偼Phase I (PISCES)偺寢壥偱偡丅Phase IIa(PISCES-II)傕偡偱偵幚巤偝傟椙岲側寢壥偑摼傜傟偨偨傔丄暷崙偱柍嶌堊僾儔僙儃懳徠帯尡Phase IIb(PISCES III)傪奐巒偡傞偙偲偑FDA偵傛偭偰擣壜偝傟傑偟偨丅偍傛偦110恖傪懳徾偵峴傢傟傞梊掕偱尰嵼旐尡幰傪曞廤拞偱偡丅
偙傟偑惉岟偡傟偽偄傛偄傛Phase III乧偦傟傕僋儕傾偡傟偽彸擣偲偄偆偙偲偵側傞偺偐側丅偟偐偟乽偨偩戀帣桼棃偺恄宱姴嵶朎偵堚揱巕摫擖偟偨傕偺偼彨棃偺娻壔側偳偺儕僗僋偑巆傝偡偖偵擔杮偱帯椕偲偟偰擣壜偝傟傞偐偼晄摟柧乿偲愳杧恀恖巵偼僐儊儞僩偟偰偄傑偡丅
2019擭1寧26擔
"Silk Biomaterial Could Regenerate the Brain After a Stroke"偲偄偆昞戣偺婰帠
偙偺婰帠偺奣梫
僗儁僀儞偺尋媶幰僌儖乕僾偼丄擼偵堏怉偟偨姴嵶朇偺惗懚婜娫傪墑偽偟丄擼峓嵡傗擼懝彎屻偺夞暅傪夵慞偡傞偙偲偑偱偒傞僔儖僋僶僀僆儅僥儕傾儖傪奐敪偟偨丅姴嵶朎堏怉偼丄懝彎偺峀偑傝傪彫偝偔偟丄慻怐嵞惗傪懀恑偡傞偙偲偵傛偭偰擼偺嵞惗傪懀恑偡傞桳朷側帯椕朄偱偡丅偟偐偟丄戝晹暘偺嵶朎偼丄懝彎屻偵擼撪偵宍惉偝傟傞墛徢忬懺偺偨傔偵惗偒墑傃側偄丅
乽懡偔偺応崌丄堏怉偝傟偨娫梩宯姴鐍朎偺傎偲傫偳偼堏怉屻1乣2埲忋廡娫埲忋偼惗懚偟傑偣傫乿偲丄儅僪儕僢僪僄壢戝妛乮倀俹俵乯偺尋媶幰偱偁傞Daniel Gonzalez-N6eto巵偼巹偵岅偭偨丏乽偙偺尋媶偱丄巹偨偪偺僶僀僆儅僥儕傾儖偼擼撪偺偙傟傜偺嵶朎偺惗懚傪係廡娫埲忋偵墑偽偡偙偲傪敪尒偟傑偟偨乿
偮傑傝丄尰嵼擼峓嵡偺屻堚徢偺帯椕朄偲偟偰娫梩宯姴嵶朎偺攟梴丒堏怉偑嵟傕桳朷偩偑丄偦偺姴嵶朎傪僔儖僋僶僀僆儅僥儕傾儖偵僇僾僙儖壔偡傞偙偲偱堏怉偟偨姴嵶朎偺惗懚婜娫傪墑偡偙偲偑壜擻偲偄偆偙偲丅
2019擭1寧12擔
僯僾儘姅幃夛幮偼2018擭12寧28擔丄嶥杫堛戝偲嫟摨偱奐敪偟偨愐悜懝彎傪懳徾偲偡傞嵞惗堛椕栻STR01(帺屓崪悜娫梩宯姴嵶朎丗僗僥儈儔僢僋)偵偮偄偰丄岤惗楯摥徣傛傝乽忦審媦傃婜尷晅彸擣乿傪摨擔晅偗偱庢摼偟偨偲敪昞偟偨丅彸擣怽惪偑2018擭6寧28擔偩偐傜敿擭偁傑傝偱彸擣偝傟偨偙偲偵側傞丅師偼偄傛偄傛擼峓嵡懳徾傪懳徾偲偟偨摨栻偺彸擣怽惪偼偢偩丅偨偩丄捈愙搳梌偱側偔惷柆搳梌偩偐傜枬惈婜擼峓嵡偵懳偡傞岠壥偼懡彮媈栤偑偁傞偺偱椪彴帋尡偺寢壥偵婜懸偟偨偄丅
娭楢儁乕僕
2018擭11寧4擔
枬惈婜擼峓嵡偵懳偡傞帀朾桼棃姴嵶朎帯椕
乽帀朾桼棃姴嵶朎傪梡偄偨嵞惗堛椕偲儕僴價儕僥乕僔儑儞傪暪梡偟偨枬惈婜擼峓嵡偺1徢椺乿偲戣偡傞榑暥偑偁偭偨偺偱彺榐傪徯夘偟傑偡丅
Click the banner

帀朾桼棃姴嵶朎傪嵦庢偟丄憹傗偟偰惷柆搳梌偡傞曽朄偼丄杔偺傛偆偵奜壢庤弍偺嵺偺媥栻乮峈寣彫斅嵻乯偑堦場偱擼峓嵡偑嵞敪偟屻堚徢偑廳撃壔偟偲恖娫偵偲偭偰偼埨怱姶偑偁傞丅偱偒傟偽丄壖惈媴杻醿偵傛傞殝壓忈奞偲峔壒忈奞偺徢椺傕側偄傕偺偐偲巚偆乧
2018擭10寧3擔
姅幃夛幮惗柦壢妛僀儞僗僥傿僥儏乕僩偺2018擭09寧03擔晅偗僾儗僗儕儕乕僗丗
惗柦壢妛僀儞僗僥傿僥儏乕僩偑擼峓嵡姵幰傪懳徾偲偟偨Muse 嵶朎惢昳偺扵嶕揑椪彴帋尡偺奐巒傪敪昞偟偨丅偙偺屻丄Phase侾丄Phase2偲懕偄偰彸擣怽惪偲側傞偺偐偦傟偲傕Phase侾傪僗僉僢僾偟偰Phase2丄彸擣怽惪偲側傞偺偐傢偐傜側偄偑丄偄偢傟偵偟偰傕妝偟傒偩丅乭擼峓嵡姵幰乭偵嵟廔揑偵偼枬惈婜擼峓嵡姵幰傕娷傑傟傞傛偆偵側傞偺偐側......偄偢傟偵偟偰傕戝偄偵婜懸偟丄傑偨椼傑偝傟傞両両両
2018擭9寧2擔
擼峓嵡偵懳偡傞娫梩宯姴嵶朎帯椕
擼峓嵡偵懳偡傞娫梩宯姴嵶朎帯椕偺尰忬偵傑偲傔偰傒傑偟偨丅
| 桼棃 | 帺壠/懠壠 | 搳梌曽朄 | 幚巤婜娫丒忬嫷 |
| 帀朾慻怐桼棃娫梩宯姴嵶朎 | 帺壠 | 惷柆搳梌 | 孃楬岶恗夛婰擮昦堾丄僋儕僯僢僋僠僋僒僸儖僘丄BTR 傾乕僣嬧嵗僋儕僯僢僋摍懡悢乕幚巤拞 |
| 崪悜桼棃娫梩宯姴嵶朎 | 懠壠 | 捈愙搳梌乮掕埵擼庤弍乯 | 僒儞僶僀僆乮嵞惗嵶朎栻SB623丂枬惈婜擼峓嵡亅帯尡拞乯 |
| 崪悜桼棃娫梩宯姴嵶朎 | 帺壠 | 捈愙搳梌乮掕埵擼庤弍乯 | 杒奀摴戝妛昦堾丂媫惈婜擼峓嵡乕帯尡拞 |
| 崪悜桼棃娫梩宯姴嵶朎 | 帺壠 | 惷柆搳梌 | 嶥杫堛壢戝妛晬懏昦堾丂媫惈婜擼峓嵡乕帯尡拞 傆偔偲傒僋儕僯僢僋乕幚巤拞 |
| 帟悜偺姴嵶朎偐傜暘斿偝傟傞僒僀僩僇僀儞 | 懠壠 | 揰旲搳梌 | 僨僀僋儕僯僢僋揤恄乕幚巤拞 |
2018擭8寧1擔
帺屓崪悜娫梩宯姴嵶朎乮STR01乯偺惢憿斕攧彸擣怽惪
嶥杫堛壢戝妛晬懏昦堾偺愐悜懝彎姵幰傪懳徾偲偟偨堛巘庡摫帯尡帯尡偵婎偯偄偰丄偮偄偵僯僾儘偑帺屓崪悜娫梩宯姴嵶朎乮STR01乯偺惢憿斕攧彸擣怽惪傪峴偭偨丅偙偺堛巘庡摫帯尡帯尡偼擼峓嵡傪懳徾偵傕峴傢傟偰偄傞偼偢偩偐傜丄戝偄偵婜懸偑帩偰傞丅搳梌曽朄偼惷柆搳梌偩偐傜怤廝惈傕掅偄丅
2018擭7寧3擔
傕偆堦偮偺壜擻惈LOTUS
2017擭9寧偺婰帠"擼峓嵡屻偺婡擻夞暅偵桳岠側暔幙LOTUS 乣擼峓嵡帯椕傊偺椪彴墳梡偵婜懸乣"偑婥偵側傞丅奜偐傜搳梌偡傞栻暔帯椕偱偁傟偽懱傊偺晧扴傕妝偩偟丄偄傠偄傠懠偺婰帠傪撉傫偱偄傞偆偪偵丄壖惈媴杻醿偵傛傞殝壓忈奞傗峔壒忈奞偵桳岠側偺偱偼側偄偐偲巚偆傛偆偵側偭偰偒偨丅傕偪傠傫柧妋側崻嫆偼側偄偑丄慺恖峫偊偱丄乽峓嵡屻偺幉嶕嵞惗傪懀恑乿偲偄偆偺偑崻嫆偲尵偊偽崻嫆偱偁傞丅偄偢傟偵偟偰傕丄憗偔幚尰偟偰傎偟偄丅偙偺墶昹巗棫戝妛僾儗僛儞僥乕僔儑儞傪偛棗偔偩偝偄丅嫟摨尋媶婇嬈傪媮傔偰偄傑偡丅
2018擭6寧30擔
姅幃夛幮惗柦壢妛僀儞僗僥傿僥儏乕僩偺2018擭01寧15擔晅偗僾儗僗儕儕乕僗丗媫惈怱嬝峓嵡傪懳徾幘姵偲偟偨Muse嵶朎惢昳偺扵嶕揑椪彴帋尡奐巒偵偮偄偰
怱嬝峓嵡懳徾偺扵嶕揑椪彴帋尡偺奐巒偑敪昞偝傟偨丅擼峓嵡懳徾偱側偄偺偑巆擮偩偑偲偵偐偔懡彮偺抶傟偼偁偭偰傕奐巒偝傟偨偙偲偵堄媊偑偁傞偲巚偆丅崱屻偺懳徾偺揥奐偵婜懸偟傑偡丅
2018擭5寧10擔
2017.05.19晅偗偺擔宱僶僀僆僥僋偺婰帠乽僯僾儘丄愐懝傪懳徾偵
帺壠MSC傪2017擭壞偐傜廐偵偐偗偰怽惪偡傞乿
乽僯僾儘偼丄2017擭5寧18擔丄2017擭3寧婜偺捠婜寛嶼愢柧夛傪奐嵜丅摨幮偼丄2014擭4寧偵嶥杫堛壢戝妛偲儔僀僙儞僗宊栺傪掲寢偟丄擼峓嵡偍傛傃愐悜懝彎偺帯椕偵梡偄傞帺壠偺崪悜桼棃娫梩宯姴嵶朎乮MSC乯偱偁傞STR01偺嫟摨奐敪傪峴偭偰偄傞丅愢柧夛偱丄僯僾儘偺嵅栰壝旻幮挿偼丄STR01偵偮偄偰丄乽愐悜懝彎傪懳徾偲偟偰2017擭壞偐傜廐偵傕彸擣怽惪傪峴偆乿偲榖偡偲偲傕偵丄尰嵼偺惢憿擻椡偲壽戣偵偮偄偰傕尵媦偟偨丅乿
偙偺擼峓嵡偍傛傃愐悜懝彎傪懳徾偲偟偨帯尡偼妋偐5擭傪栚搑偵2013擭偵奐巒偝傟偨偼偢偩丅崱2018擭1寧尰嵼彸擣怽惪偺僯儏乕僗偼側偄偐傜崱擭拞偲偄偆偙偲偵側傞偲巚傢傟傞丅愐悜懝彎懳徾偺帯尡偺曽偑愭偵廔椆偟偨偺偐傕偟傟側偄丅偳偪傜偵偟偰傕帯尡偑妋幚偵幚巤偝傟偰偄傞傛偆偩丅擼峓嵡懳徾偑偙傟偵懕偔偙偲傪戝偄偵婜懸偟偨偄丅婐偟偄僯儏乕僗偱偡丅
2018擭3寧3擔
Muse嵶朎嵟怴忣曬
2018擭1寧15擔丄姅幃夛幮惗柦壢妛僀儞僗僥傿僥儏乕僩偑媫惈怱嬝峓嵡傪懳徾幘姵偲偟偨Muse嵶朎惢昳偺扵嶕揑椪彴帋尡奐巒傪敪昞丅崱夞偼懳徾幘姵偑媫惈怱嬝峓嵡偱偡偑丄Muse嵶朎偼丄傕偲傕偲丄乽擼峓嵡摦暔儌僨儖偺幐傢傟偨恄宱婡擻偺夞暅偵惉岟偟傑偟偨乿偱偡偐傜丄偄偢傟擼峓嵡傪懳徾幘姵偲偟偨椪彴帋尡奐巒傕婜懸偟偨偄偱偡両偍偍偄偵椼傒偵側傝傑偡偹丅
搶杒戝妛戝妛堾堛妛宯偺WEB儁乕僕偵丄Muse嵶朎偺幚梡壔傗帯尡偵娭偟傑偟偰偼噴惗柦壢妛僀儞僗僥傿僥儏乕僩偺僂僃僽僒僀僩傪嶲徠捀偔偐丄壓婰偺晹彁傑偱偍栤崌偣捀偗傑偡傛偆偍婅偄怽偟忋偘傑偡丄偲偁傝傑偡丅噴惗柦壢妛僀儞僗僥傿僥儏乕僩偺WEB僒僀僩偼偙偪傜偐傜丅乽惗柦壢妛僀儞僗僥傿僥儏乕僩偱偼丄Muse 嵶朎惢嵻傪梡偄偨椪彴帋尡傪棃擭搙偐傜奐巒偟丄怱嬝峓嵡傪懳徾偲偟偨帯尡幚巤偵傛傝桳岠惈偲埨慡惈傪妋擣偟偨偺偪丄偝傑偞傑側幘姵傪懳徾偲偟偨奐敪傊揥奐偟偰偄偔梊掕偱偡丅乿偲偁傝傑偡丅偝傑偞傑側幘姵偺拞偵偼丄擼峓嵡傕娷傑傟傞偱偟傚偆偐傜丄戝偄偵婜懸偱偒傑偡偹丅
杒戝偺帯尡偵娭偡傞捛壛忣曬
帯尡偺徻嵶側撪梕傪抦傞偵偼丄偙偺WEB僒僀僩傪偍姪傔偟傑偡丅帯尡偲暲峴偟偰師偺俁偮偺尋媶偑幚巤偝傟揰偑摿昅偝傟傞丅埨慡側嵶朎攟梴乕摦暔桼棃惢嵻傪巊梡偟側偄攟梴塼偺妋棫丄埨慡側嵶朎堏怉朄乕掕埵揑憰抲偲堏怉梡僾儘乕僽傪巊梡偟偨擼撪堏怉丄堏怉嵶朎偺摦懺捛愓乕SPIO偱儔儀儕儞僌偟偨嵶朎傪MRI偱捛愓偺3偮偩丅摿偵堏怉偟偨嵶朎偺摦懺捛愓偼嫽枴怺乆偩丅
2018擭2寧2擔
尰嵼丄姴嵶朎傪梡偄偰擼峓嵡屻屻堚徢偵懳偡傞帯椕傪採嫙偟偰偄傞昦堾傪徯夘偟傑偡
孃楬岶恗夛婰擮昦堾乮杒奀摴乯
姵幰偺帀朾慻怐偐傜娫梩宯姴嵶朎傪暘棧偟偰悢愮枩乣侾壄屄傎偳傑偱攟梴偟偰惷柆搳梌傑偨偼嬊強搳梌傪峴偆帀朾桼棃姴嵶朎帯椕偱偡丅僒僀僩偵帯椕旓傪娷傒徻嵶側愢柧偑偁傝傑偡
堛椕朄恖戝夒夛丒傆偔偲傒僋儕僯僢僋乮戝嶃巗乯
崪悜慂巋偵傛傝崪悜塼傪嵦庢偟崪悜姴嵶朎傪攟梴偟傑偡丅偦傟傪栺4廡娫娫妘偱崌寁3夞偺揰揌偵傛傝懱撪偵搳梌丅偙偪傜傕徻嵶側愢柧偑偁傝傑偡偐傜僒僀僩傪偛棗偔偩偝偄丅
僨僀僋儕僯僢僋揤恄乮暉壀導暉壀巗乯
擕帟悜姴嵶朎攟梴忋惔塼偵傛傞帯椕丅搳梌曽朄偼揰旲丅乽仸尰嵼偺偲偙傠巆擮側偑傜擼峓嵡屻偺擼婡擻忈奞偵偮偄偰偼姰慡側岠壥傪帵偡曬崘偼傑偩側偝傟偰偍傜偢丄塣摦杻醿乮塣摦忈奞乯偵娭偟偰偺傒曬崘偑側偝傟偰偄傞忬嫷偱偡丅乿偲偄偆婰嵹偑偁傞丅
嶥杫堛壢戝妛晬懏昦堾偺帯尡
偙傟傕偆傟偟偄僯儏乕僗偱偡丅杒戝偺僯儏乕僗偲偄偄杒奀摴偼偡偛偄偱偡偹丅椺偊偼揔愗偱側偄偐傕偟傟側偄偗偳丄峛巕墍偺桪彑婙傒偨偄偱偡偹丅敀壨偺娭傪偄偮墇偊傞偺偐偲懸偭偰偄傞偆偪偵.....搶杒傪僗儖乕偟偰杒奀摴偵峴偭偰偟傑偭偨丅姵幰杮恖偐傜嵦庢偟偨崪悜塼拞偺崪悜娫梩宯姴嵶朎傪暘棧偟攟梴偟偰帯尡栻傪嶌傝丄揰揌搳梌偡傞偙偲偱擼峓嵡屻堚徢偺寉尭傪栚巜偡偲偄偆傕偺丅摨偠傛偆側帯椕偼戝嶃傗暉壀側偳偺柉娫昦堾偱偡偱偵幚巤偝傟偰偄傞傛偆偱偡丅搶杒偐傜傕偆傟偟偄僯儏乕僗偑撏偔偙偲傪婜懸偟傑偡丅慺恖偑偁傟偙傟愢柧偡傞傛傝傕嶥杫堛壢戝妛晬懏昦堾偺WEB僒僀僩傪偛棗偵側傞傎偆偑憗偄偱偟傚偆丅帯尡偲偼丄偐傜巒傑傞崸愗傪挌擩側愢柧傪偤傂偛棗偵側偭偰偔偩偝偄丅嵞惗堛椕帯尡偺偍抦傜偣
2017擭12寧10擔
杒戝丄擼峓嵡偺嵞惗堛椕偱帯尡奐巒
2017擭11寧14擔晅偗偺偺擔杮宱嵪怴暦揹巕斉偵慺惏傜偟偄婰帠偑宖嵹偝傟傑偟偨丅杒奀摴戝妛偑擼峓嵡偺姵幰帺恎偺姴嵶朎傪巊偭偨嵞惗堛椕偺椪彴帋尡乮帯尡乯傪巒傔偨偲敪昞偟偨偺偱偡丅擼峓嵡偺姵幰帺恎偺崪悜偐傜嵦庢偟偨姴嵶朎傪攟梴偟偰堏怉偡傞嵞惗堛椕偱偡丅1椺栚偼偡偱偵8寧偵偼擼撪偵捈愙拲擖偟偨偦偆偱丄2椺栚偼11寧忋弡偵幚巤丅姴嵶朎堏怉屻1擭偵傢偨偭偰埨慡惈傗桳岠惈傪挷傋傞偲偄偆偙偲偱偡偐傜丄2018擭11寧偐12寧偵偼壗傜偐偺寢壥偑弌傞偺偱偼側偄偐偲婜懸偟偰偄傑偡丅
偄傛偄傛嵞惗堛椕傪庴偗傜傟傞擔偑尰幚枴傪懷傃偰偒傑偟偨偹丅寢壥偑妝偟傒偱偡丅
杒奀摴戝妛昦堾偺擼峓嵡姵幰傪懳徾偲偟偨帺壠崪悜悜堏怉帯椕乮堛巘庡摫帯尡乯奐巒偺偍抦傜偣偼偙偪傜偐傜
2017擭12寧10擔
iSC嵶朎(嫊寣桿摫惈懡擻惈姴嵶 朎)偺堏怉偱擼峓嵡偱巰傫偩擼嵶朎傪嵞惗
暫屔堛壢戝妛愭抂堛妛尋媶強尋媶僌儖乕僾偑2009擭偵擼峓嵡偺慻怐偺拞偵恄宱嵶朎傪偮偔傞嵶朎偑偁傞偙偲傪敪尒偟傑偟偨丅偦偟偰偙偺嵶朎傪攟梴丒堏怉偡傞偲乽巰傫偩恄宱嵶朎偑嵞惗偟偨乿偲偡傞婎慴尋媶偺惉壥傪敪昞偟傑偟偨乮恄屗怴暦NEXT2016擭1寧5擔乯丅敪尒偝傟偨懡擻惈姴嵶朎偼懱撪偱帺慠偵惗傑傟傞帺壠嵶朎偱偡丅尋媶僌儖乕僾偼廳徢偺擼峓嵡傪婲偙偟偨姵幰偺擼偱傕懡擻惈姴嵶朎偺懚嵼傪妋擣偟丄iSC嵶朎乮嫊寣桿摫惈懡擻惈姴嵶朎乯偲柤偯偗傑偟偨丅婛偵攟梴偟偨儅僂僗偺iSC嵶朎傪儅僂僗偺擼偵堏怉偟丄惓忢偵婡擻偟偰偄傞忬懺傪妋擣偟偰偄傑偡丅傑偨2016擭11寧偵丄擔杮堛椕尋媶奐敪婡峔偺巟墖傪庴偗偰僗僞乕僩偟偨婎慴尋媶偱偼丄僸僩偺iSC嵶朎傪儅僂僗偵堏怉偟丄惉壥傪妋偐傔偰傑偡丅iSC嵶朎偼傕偲傕偲僸僩偺懱撪偱嶌傜傟偰偄傞偺偱丄堏怉偟偰傕偑傫敪徢偺儕僗僋偼掅偄偲偝傟偰偄傑偡丅暫屔堛壢戝偺僌儖乕僾偼丄崱屻俀擭梋傝偱丄椪彴帋尡偺慜抜奒傑偱帩偭偰偄偒偨偄榖偟偰偄傞偦偆偱偡丅椪彴帋尡偺擔偑懸偪墦偟偄偱偡偹丅
擔杮偺嵞惗堛椕偺尰忬
擔杮偺嵞惗堛椕偺尰忬傪抦傞偵偼丄NHK偺僋儘乕僘傾僢僾尰戙乽擼偑傛傒偑偊傞両丠嵞惗堛椕戝崙丒擔杮偺媡廝乿偲偄偆斣慻傪偍姪傔偟傑偡丅戝偄偵椼傒偵側傝傑偡丅
僋儘乕僘傾僢僾尰戙乽擼偑傛傒偑偊傞両丠嵞惗堛椕戝崙丒擔杮偺媡廝
