| 5 温泉の化学 5-4-5 非火山性の酸性泉 −微生物がつくる温泉 前節までお話しした火山性の酸性泉は、いずれも高温で湧出量がたいへん多いことが特徴ですが、酸性泉のなかには、これとは逆に、低温で湧出量がきわめて少ないグループも別に存在しています。これらの温泉の多くは、ひっそりと単独で湧出している「冷鉱泉」で、大温泉地を形成することはありません。しかし、酸性泉独特の効能で、地域の人々からは「薬湯」として大切にされているものが少なくありません。今回はこのような愛すべき温泉(鉱泉)たちが、どうやって生まれてくるのか考えてみましょう。 酸性泉のpH−温度分布 下の図に、pH6 以下の温泉について、pHと泉温の関係を示してみました。これをみると、pH3 以下泉温45℃以上のあたりに大きな集団があり、これは火山性酸性泉に相当しています。いっぽうで、泉温25℃以下で、pHは1.5〜4.2あたりにひとつの集団があることがわかります。これを仮に「低温酸性泉」とよんでおきましょう。火山性の集団とは連続性がない(泉温40℃付近にギャップがある)ことから、成因的には独立したものをもっていると考えられます。ずっと前の5-4-2章の最初の図で示したように、低温酸性泉の分布が火山から離れていることからも、これらが火山とは成因的に関係ないらしいことが伺えます。 注)泉質分類では、pH3 以下を「酸性−」としていますが、本稿ではpH4.5以下を酸性泉とみなしています。「二酸化炭素による通常水の酸性化」が及ばない領域であるからです。 |
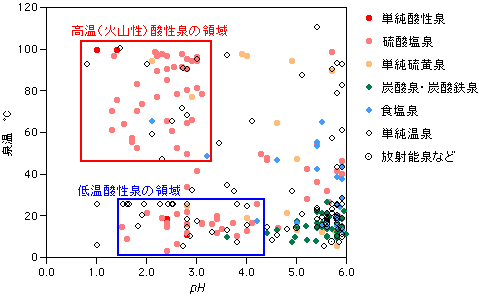
図5-4-5-1 酸性領域の温泉のpH−泉温の関係
さて、図では泉質による色分けも同時に示しています。低温酸性泉の大部分は硫酸塩泉で、単純温泉のほとんども硫酸塩型の泉質をもっています。正式に書くと、Fe(II)−硫酸塩泉または
Fe(II)・Al−硫酸塩泉、いわゆる緑礬泉・明礬緑礬泉(旧泉質名)です。この泉質は火山性酸性泉と同じですから、「古い時代の火山性酸性泉が地中に取り残されて冷えたものじゃないの?」と思われる方も当然おられるでしょうが、前節で述べたように、酸性泉には岩石の成分を大量に溶かし込む性質があるため、いつまでも強い酸性を保っておくことができずに「中和」されてしまいます。このへんが長期間にわたって成分が安定な「化石海水」などとの大きな違いです。つまり、「化石酸性泉」はできにくいってことです。 |

図5-4-5-2 大型の立方体に成長した黄鉄鉱の結晶
新鮮なものは金色に輝く金属光沢をもつ
| 硫化鉱物(黄鉄鉱)の酸化溶解 − 無機的メカニズム さてと、黄鉄鉱はふつうの水に接しても、ほとんど溶けません。とくに酸性領域の水に対しては非常に安定です。しかし、酸素(O2)を含む水(酸化水)に対しては、化学変化をおこして溶けるようになります。(以下は笹本1998に基づく、原著は Singer and Stumm 1970) FeS2 + 7/2・O2 + H2O = Fe2+ + 2・SO42- + 2・H+ ・・・・(1) 黄鉄鉱(FeS2)が酸素により酸化され、鉄(II)イオンと硫酸イオンを生じる反応です。わりと単純ですね、たったこれだけで、酸性のFe(II)−硫酸塩泉ができてしまいます。左辺に酸素(O2)が加わると、右辺に水素イオン(H+)が出てくるのがミソです。 これでおしまい? いえいえ事はそう単純にはいきません。 (1)の反応は非常にゆっくりとしたスピードでしか進まないので、これだけではほんの僅かの硫酸を生産することができるだけです。黄鉄鉱をコップの水に浸けて置いたところで、見た目には何の変化もないでしょう。自然界でおきる黄鉄鉱の溶解には、以下に述べるように微生物の活動が大きな役割を果たしているのです。 地中微生物のはたらき − 有機的メカニズム 地下の世界は、一見したところ何の生物活動もないように見えますが、実際にはとてもたくさんの微生物(細菌類)が棲息しています。このなかには、無機化合物の酸素による酸化だけで、生育に必要な全エネルギーを得ている細菌もおり、「独立栄養細菌」とよばれています。黄鉄鉱の溶解で活躍するのは、このうち「鉄酸化細菌」と「硫黄酸化細菌」の2種で、それぞれ代表的なのは、Thiobacillus ferrooxidans、Thiobacillus thiooxidans、という種類です。長たらしい学名ですが、それぞれお尻に(oxidan=酸化する)っていう名前がつけられています。 (1)で生じた鉄(II)イオンは、酸性の水中ではかなり安定に存在できますが、鉄酸化細菌が作用すると、 4・Fe2+ + O2 + 4・H+ = 4・Fe3+ + 2・H2O ・・・・(2) というように、鉄(II)イオンが、さらに酸素酸化をうけて鉄(III)イオンになります。この反応は鉄酸化細菌のもつ酵素の働きで、100万倍も加速されます。 鉄(II)イオンの水溶液は美しい澄んだ緑色なのですが、(2)の反応がおこると、鉄(III)イオンが水酸化鉄として沈殿し、溶液は血のような赤色に変わるようになります。鉱山の排水が赤水なのは、おもにこのせいです。この段階で黄鉄鉱の表面は水酸化鉄で覆われ、赤錆び色になっていきます。 FeS2 + 14・Fe3+ + 8・H2O = 15・Fe2+ + 2・SO42- + 16・H+ ・・・・(3) (2)で生じた鉄(III)イオンは、再び黄鉄鉱と反応して、鉄(II)イオンと硫酸イオンを再生します。右辺の数字を比較するとわかるように、水素イオンが8倍も多く生産されるので、溶液はどんどん酸性化していきます。 FeS2 + 2・Fe3+ = 3・Fe2+ + 2・S ・・・・(4) pH2 近くにまでなると、(4)の反応も同時におこって、単体硫黄(S)を生じるようになるとともに、再び鉄(II)イオンが生産されるようになります。これはさらに(2)の反応に加わるようになるので、鉄酸化細菌の食べ物がいっそう増えて、細菌がどんどん増殖していきます。鉄酸化細菌が(2)の反応で生産するエネルギーは、Fe2+が1モルあたり8kcalくらいの僅かなものと推定されています(山中1992)が、それでも大量にあつまれば、地下水の温度をちょっぴり上げるくらいのことはできます。 2・S + 3・O2 + 2・H2O = 4・H+ + 2・SO42- ・・・・(5) (4)で単体硫黄ができると、こんどは硫黄酸化細菌の出番となり、硫黄を酸化して硫酸イオンを大量に生産していきます。最終的に(2)-(4)の循環に(5)が加わって、黄鉄鉱はきわめて迅速に溶けて無くなってしまうか、鉄錆びみたいな水酸化鉄の塊に姿を変えてしまいます。下図の写真が、こうやってできたと思われる黄鉄鉱の形骸で、長野県では「武石」とよばれる名物になっています。(なぜこう呼ばれるのでしょう?ご存じの方、お知らせください) |

図5-4-5-3 凝灰岩中にみられる「武石」(長野県武石村)
黄鉄鉱の外形はそのままで、中身は完全に水酸化鉄に置き換わっている
| さてと、ここまでのところで、黄鉄鉱がもとで酸性泉ができることがわかりました。すでにお気付きの方もいるでしょうが、このメカニズムは酸素を含んだ水(地表水・浅層地下水)が供給されるところでないとうまく働きません。つまりは、酸素をほとんど含まない深層地下水の条件下では、ほとんど起こらない現象といえます。このことが、低温酸性泉が「低温である」原因です。自然地温の上昇で深層地下水が「温泉」といえる温度に達するような環境では、鉄酸化細菌や硫黄酸化細菌に代わって、こんどは硫酸イオン(SOSO42-)を硫黄(S)や硫化水素(H2S,HS-)に還元するような細菌類のほうが主役になっていきます。 社会のお役にも立っている 黄鉄鉱の酸化による酸性水の生産は、温泉ファンにとっては有り難い現象ですが、その反面、環境への被害ももたらします。黄鉄鉱は主成分の鉄とともに、ヒ素(As)やカドミウム(Cd)などの有害な重金属も含んでいるからです。黄鉄鉱の分解でこれらの重金属が放出され、酸性水とともに大量に河川に流入したりすると、下流の生態系にとっては極めて迷惑な事態となります。 温泉がちょろちょろ流出したくらいでは、そう大きな問題にはなりませんが、休・廃止鉱山の坑道などから大量の排水が垂れ流されると、深刻な公害になります。日本でも戦時中に開発されて戦後放置された鉱山では、排水対策がなおざりにされたために、あちこちで下流域に重金属汚染が起こりました。筆者の田舎でも、稲からカドミウムが検出されて、お米の販売ができなくなったことがありました。この防止対策として、酸性水の薬品中和とともに、ちょっと面白い方法がとられています。そこではまたまた鉄酸化細菌が活躍しています。 つまり、鉄酸化細菌を効率的に繁殖させて、上記(2)の反応の応用により、排水中に溶けている鉄(II)イオンを鉄(III)イオンに変え、水酸化鉄として沈殿・除去しているのです。水酸化鉄が沈殿するときには、鉄とともに先のような重金属類をも同時にくっつけてきます(共沈現象)ので、排水からこれらをかなりの量取り除くことができます。こうして除去した沈殿物からは、産業用資源として重金属を回収しています。鉄酸化細菌は、意外なところで社会のお役にも立っているのです。 マイナスpHの温泉!? − 世界最強の酸性泉(関連するおまけ) あれ、pHってマイナスになることあるの? 0〜14の範囲じゃなかったの? って怪しまれる方も多いでしょう。たしかに通常の希薄水溶液ではそうですが、水素イオン濃度が非常に濃くなり、その活量(5-3章)が大きくなれば、pHがマイナスの値をとることだって十分にありえます。pH=-log(aH)の定義を思い出してみてください。aH(水素イオンの活量)が1を越えると、pHはマイナスの値をとるようになります。 ただし、通常のpHメーター(ガラス薄膜電極)ではそんな範囲を扱うようには設定されていないので、pH0.5以下では、特別に工夫した絞正方法をとらなければなりません。これまでに、そんなふうにして測定されたマイナスpHの温泉は、いずれも火山の近傍に出るいわゆる火山ガス凝縮型(Type-A)の温泉からいくつか報告があり、最高でpH=-1.7 というのが知られていました。 ところが最近、アメリカのカリフォルニアの山中にある廃止鉱山(塊状硫化鉄鉱床)の坑内から、pH=-3.6 という驚異の強酸性水が排出されていることがわかりました(→参考WEB)。これはどうやら未採掘の硫化鉱物に地下水が浸透し、上記の酸化作用でつくられた強酸性水が坑内に滲みだしてきたもののようです。 主成分はFe-SO4(緑礬泉)で、排水の温度は29℃から47℃にわたっていますから、これはどうみても「温泉」です。もっとも、マイナスpHを示す酸性水の湧出量は1ガロン/分(0.26L/分)以下と少量ですが、pH=1くらいまでの酸性水だけでも最大1000ガロン/分(264L/分)排出してるそうですから、下流の環境への影響が懸念されます。幸い、大きな被害は報告されておらず、水処理設備もつくられているようなので、まずはひと安心です。 さて、こんな恐るべき強酸性の温泉が、いったいどんな成分濃度なのか、興味のあるところです。以下に報告された分析値(一部)をのせておきます。残念ながらpH=-3.6の試料は数値が出ていませんが、pH=-2.4の試料でも成分総計は850g/Lに達しています。単位がmgではなく、g であるのがなんともすごいところです。 |
強酸性水の化学分析値(NAは未分析)
| sample code | pH | T (C) | SO4 g/L |
Fe(total) g/L |
Fe(II) g/L |
Zn g/L |
Cu g/L |
Cd g/L |
Pb g/L |
As g/L |
| 90WA108 | -0.35 | 43.5 | 420 | 55.6 | 50.8 | 6.15 | 0.578 | 0.043 | 0.0043 | 0.169 |
| 90WA109 | -0.7 | 38 | 360 | 86.2 | 79.7 | 7.65 | 2.34 | 0.048 | 0.0038 | 0.154 |
| 90WA110A | -2.5 | 42 | 760 | 124 | 34.5 | 23.5 | 4.76 | 0.211 | 0.012 | 0.34 |
| 90WA110B | -2.4 | 42 | 650 | 141 | 34.9 | 20 | 3.18 | 0.172 | 0.011 | 0.222 |
| 90WA110C | -3.6 | 46 | NA | 16.3 | 9.8 | NA | NA | NA | NA | NA |
| Acidic
Mine Waters Found in the Richmond Mine, Iron Mountain, CA
during September 1990a Environ. Sci. Technol., 34 (2), 254 -258, 2000. 10.1021/ Negative pH and Extremely Acidic Mine Waters from Iron Mountain, California Darrell Kirk Nordstrom, Charles N. Alpers, Carol J. Ptacek, and David W. Blowes [5-4章 参考図書・参考文献] |