| 5 温泉の化学 5-4-4 火山性酸性泉(3) 化学的な特性 酸性泉は様々な化学的特性をもっていますので、そのうちいくつかの面白い点を指摘しておきたいと思います。 Cl-/SO42-比 前節でも触れましたが、これは酸性泉のできかたを推定する目安にもなっています。各タイプの数値をpHと比較してみると、たいへん明瞭に分かれていることが見て取れると思います。 1) pHがひじょうに小さく(2以下)、Cl-/SO42-比が1以上のもの → Type-B1 2) pHは主に3以下で、Cl-/SO42-比が1以下 → Type-B2 3) pHは主に2以上で、Cl-/SO42-比は0に近い → Type-C みなさんのお気に入りの酸性泉はどのタイプのものでしょうか? |
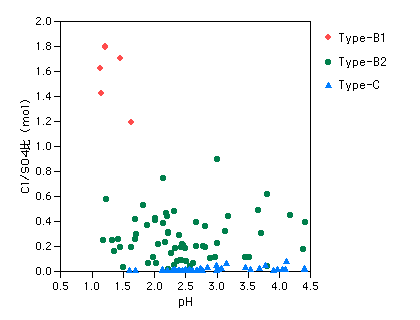
図5-4-4-1 Cl-/SO42-比
なお、酸性泉の領域には、少ないながらNa-Cl型のものも存在し、このCl-/SO42-比は当然ながら大きい値となります。これは、酸性泉ができるときに、噴気ガスが混合する相手の地下水が、すでに塩化物泉であった場合です。ややこしくなるので図には表示してありませんが、Na+に対応する量(mval)のCl-を除く計算をすると残りがほとんどなくなりますので、容易に区別することが出来ます。 |
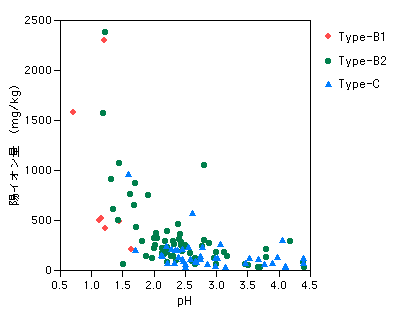
図5-4-4-2 陽イオン総量
| さらに、同じpHでくらべると、前節で触れたように、Type-B1とB2では陽イオン量にかなりの差があることが見て取れます。酸性泉をつくりだす源の噴気ガスには、Cl-やSO42-などの陰イオンを形成する成分はたくさん含まれていますが、H+以外の陽イオンの物質はほとんど含まれていません。したがって、これらの陽イオンは、酸性泉が周辺の岩石成分を溶かし込んできたものとみなすことができます。溶かし込む相手の岩石の種類(組成)によって、酸性泉の陽イオンの成分はいろいろに変わってきますので、このへんが温泉それぞれの個性となってきます。 日本では火山体をつくる岩石は、概ね安山岩や石英安山岩といった似たものが多いので、酸性泉の個性のばらつきも小さいですが、海外では特殊な岩石と反応してできた珍妙な陽イオン組成の温泉も知られています。例えば日本ではMgを主とするいわゆる正苦味泉(Mg−硫酸塩泉)はかなり珍しいですが、アメリカやカナダの西海岸ではMgに富む蛇紋岩(Serpentine)という岩石が広く分布していて、火山の近傍には正苦味泉が頻繁に湧出しているらしいです。一度訪問してみたいですね。 Fe・Alイオン量 陽イオンのうち、酸性泉を特徴付ける Fe・Alイオンの量をみてみましょう。図は縦軸が対数目盛になっていますが、pH=1からpH=4のあいだでは、イオン量(総mg)が1/1000もの格差があります。これは何を表しているのでしょうか? もちろん、温泉個々の状態の違い、岩石との接触時間の差や地表水との混合の割合といった要因もありますが、タイプによる差があまりみられないので、主にはpHによる違いが大きく関係していることは間違いありません。 |
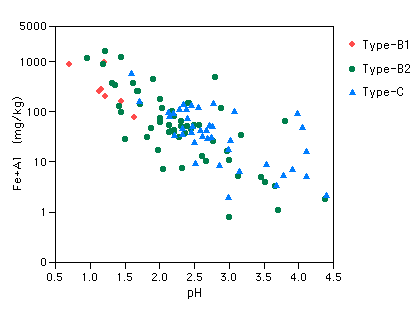
図5-4-4-3 Fe・Alイオン量
| 岩石をつくる鉱物は、SiとAlの酸化物からなる強固な骨格に、FeやCa・Naがはめ込まれた形でつくられています。普通の造岩鉱物は水に触れてもほとんど溶解しませんが、酸性になると、鉱物の骨格が破壊されて各成分がバラバラの状態にされるので、非常にたやすく溶かし出されるようになります。陽イオンの岩石からの溶け出しやすさは、CaやNaといったアルカリ・アルカリ土類の元素で高く、FeやAlはかなり溶けにくいほうです(イオン化傾向の差)。 このため、酸性泉が通過する当初は、岩石からCaやNaを大量に溶かし出しますが、しばらくするとこのような成分はほとんど岩石から無くなってしまい、後に残ったFeやAlばかりが溶け出してくるようになります。酸性が強いほど、この作用は早くおこるので、陽イオンに占める Fe・Alの割合が高くなってくるのだと考えられます。 |
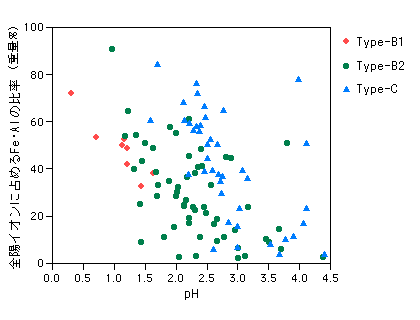
図5-4-4-4 陽イオン全体に占めるFe・Alイオンの割合