| 5 温泉の化学 5-4-2 火山性酸性泉(1) 数多くの温泉地を訪問する温泉ファンでなくても、酸性泉が火山の近傍によく出ていることはよく知られています。高温で強い酸性をしめす温泉は、火山性温泉に特徴的なもので、温泉の王様ともいえます。 |
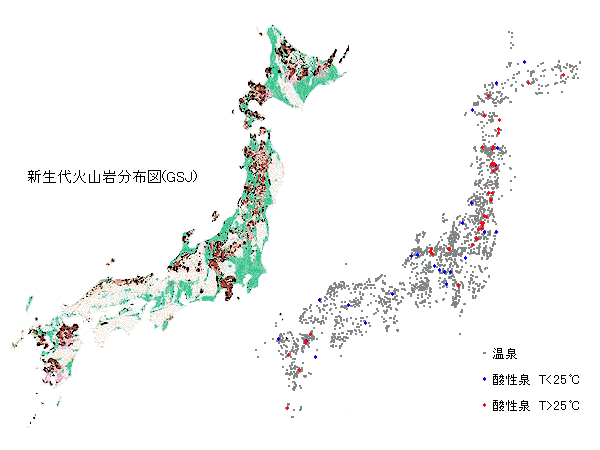
図5-4-4 火山岩の分布(左)と酸性泉の分布(右)
酸性泉と火山の分布 |

図5-4-5 火山ガス採取の様子(USGS)
| 火山性の噴気には、今まさに噴火している火口から溶岩とともに放出される超高温なものや、大型の噴気孔から轟音とともに噴出する高温噴気、なんとか手で触れることのできるくらいの低温の噴気など、いろんな温度のバリエーションがあります。火山ガスを専門に研究している学者は、なんとかして噴火中の火口近くで新鮮な高温ガスを採取してみたいものだと願っていますが、大変危険なので実際の測定例はあまり多くありません。測定中に突発的な噴火で亡くなった火山学者もたくさんいるのです。最近では紫外線の吸収スペクトルを応用してガス組成を計測する装置(COSPEC)なども開発されていますから、おおよその値を知ることは比較的容易になりました。 |
表5-4-1 火山性噴気の主なガス組成(H2Oを除いた分) 岩崎ほか(1962)などによる
| タイプ | 温度 | H2O以外の化学成分の量比 | ||||
| HCl | HF | SO2 | H2S | CO2 | ||
| 火口放出ガス | 1200〜800℃ | *** | * | *** | * | *** |
| 高温噴気孔(A) | 800〜100℃ | *** | * | *** | ** | *** |
| 高温噴気孔(B) | 〜100℃ | - | ・ | ** | ** | *** |
| 温泉ガス(A) | 100〜60℃ | - | - | ・ | ** | *** |
| 温泉ガス(B) | 60℃以下 | - | - | - | * | *** |
(***:多、**:中、*:少、・:微量、-:なし)
| 上の表は、現在までに測定されたさまざまなタイプの噴気ガスについて、温度による化学成分の違いをまとめたものです。火口から放出される超高温のガスには、二酸化硫黄(SO2)と塩化水素(HCl)が多く、温泉でおなじみの硫化水素(H2S)はわずかしか含まれていません。 高温噴気孔からのガスには2種類あり、(A)HClとSO2が主体のものと、(B)HClはわずかでSO2とH2Sが主体なものがあります。とくにHClの量と、SO2:H2Sの比率にはずいぶん差があります。どうしてこのような違いがあるのかはあまりよく分かっていませんが、以下のように解釈されています。 1) マグマの組成によって変わる: 玄武岩質のマグマはイオウ(S)成分が多く、逆にデイサイト質のマグマには塩素(Cl)成分が多い。 2) SO2とH2Sの比率はマグマから放出されたときの温度によって変化する: SO2 + 3H2 = H2S + 2H2O ・・・(1) の反応で、温度の高いほど左側が多くなる。 3) HClは水にきわめて溶けやすい: ガスの通路で温度が下がり、わずかに水蒸気が凝縮するとそれに溶け込んで除かれてしまう。 高温の酸性泉ができる素は、高温噴気孔ガスが重要な役割をしていますので、このような違いが各地の酸性泉の個性をつくりだしています。日本の酸性泉の多くは、HClをほとんど含まない「高温噴気孔(B)」のようなガスが素になっているといわれていますが、玉川温泉(秋田)、川湯温泉(北海道)、川原毛湯滝(秋田)などは、「高温噴気孔(A)」や「火口放出ガス」に近いような、HClやHFを比較的多く含むガスが素になっていると考えられています。 |

図5-4-6 川原毛地獄(秋田県)の高温噴気
| 酸をつくる化学反応 上の表にあるようなガス成分が水に溶けると、以下のような化学反応がおこって各種の「酸」をつくりだします。 そのまえに、「酸」の定義を化学の教科書で復習してみると、「酸(Acid)とは水の中で電離して水素イオン(プロトンH+)を生じる物質である」ってことで、古典的な「アレニウスの定義」といわれます。その後で、「酸とはほかの物質に水素イオンを与える物質である」っていう「プレンステッドの定義」が出されてこれが一般的になっています。後者では水溶液だけでなく固体にも広範囲に適用できるという強みがあります。で、後者の定義でいうところの水素イオンが与えられるほうの物質とは、ほかでもなく水(H2O)です。以下の式でH+と書いてあるのは、実際にはH3O+のことです。 5-3章で、「pHは水素イオンの活量の指数」ということがわかりましたから、水素イオンをいっぱい出す酸がたくさん溶け込んでいる水ほど「酸性」が強い(pHが小さい)ことになります。あたりまえですが念のため。 <塩化水素 HCl> HClはひじょうに水に溶けやすいガスです。水への溶解度はSO2の数十倍、H2Sの数百倍もあります。HClは次のように解離し、この水溶液を塩酸といいます。この割合はほぼ100%おこるために、たいへん強い酸性をしめします。 HCl → H+ + Cl- ・・・(2) 塩酸は金属酸化物をよく溶かしますが、岩石中の鉱物とはあまり反応しないので、塩酸を多く含む酸性泉は中和されにくく、強い酸性を保ったまま地表へ湧出してきます。 <フッ化水素 HF> HFもひじょうに水に溶けやすいガスで、次のように解離してこれをフッ酸(フッ化水素酸)といいます。 HF → H+ + F- ・・・(3) 解離する割合はあまり多くないので、弱い酸しかつくることはできません。しかし、フッ酸には岩石中に多い石英をよく溶かすという特異な性質があります。また、たいていの珪酸塩鉱物もほかの酸より容易に分解してしまいますので、酸性泉に溶存する陽イオン成分の増加に大きく貢献していると思われます。 ただし、フッ素イオン自身はCaなどのアルカリ土類と結合して難溶性の化合物(CaFホタル石など)をつくりやすく、すぐに沈殿してしまいますので、温泉水中の含有量はあまり多くありません。酸性泉の裏方さんといえるでしょうか。 <二酸化炭素 CO2> 火山ガス、噴気孔ガス、温泉ガスのいずれにも大量に含まれていますが、酸性領域での水への溶解度はひじょうに小さく、また、解離する割合も小さいので、酸性泉をつくりだすことにはほとんど貢献していません。詳しくはまた別の章で。 <二酸化硫黄(亜硫酸ガス) SO2> 火山ガスや高温の噴気孔ガスに多く、水に溶けると亜硫酸(H2SO3)をつくります。 SO2 + H2O → H2SO3 ・・・(4) 亜硫酸は水中で以下のように解離しますが、その割合は多くないので、弱酸性になります。 H2SO3 → HSO3- + H+ ・・・(5) <硫化水素 H2S> 比較的低温の噴気ガスや温泉ガスに多く含まれていますが、水にはほとんど溶解しません。溶解した分は水中で以下のように2段に解離しますが、その割合は小さく、弱酸性になります。 H2S → H+ + HS- ・・・(6) HS- → H+ + S2- ・・・(7) 硫酸はどうやってできるのか? ここまで読んで、はて? 酸性泉には硫酸(H2SO4)が多く含まれていると聞いていたけど? と疑問に思われている方も多いでしょう。それは正解です。 ほとんどの酸性泉で強い酸性をしめしている主役は硫酸です。が、上の(5)や(6)のように、二酸化硫黄や硫化水素が単に水に溶けただけでは、硫酸をつくり出すことはできません。 酸性の温泉に含まれるイオウ化学種のガスは、ほとんどが硫化水素であることから、当初考えられたのは、以下のような反応です。 H2S + 2O2 → H2SO4 ・・・(8) 硫化水素の酸化(ほんとうはもうちょっと複雑) これは硫化水素が酸素を含む地下水に吹き込んで、酸化反応で硫酸がつくられる、としたものです。が、実際に地下水の酸素含有量はそう多くないので、これではたいした量の硫酸をつくることはできそうにありません。さらに、地下深部では酸素がほとんどない還元性の環境にありますから、ますます無理な相談になってきます。 ただし、銅などの重金属が多くあると、これが触媒となって(8)の反応が進行しやすくなるっていうことはあるみたいです(村松さん談)。現実に地熱発電所では大量の硫化水素を出すと環境問題になるので、似たような方法で硫酸に変えて排気から回収除去していますが、それはまた別の話。 で、最も有力とされているのが「二酸化硫黄の自己酸化作用」っていうなにやら厳めしいものです。その生成機構は以下のごとくちょっと複雑です、よーくごらんください。 SO2 + H2O → H2SO3 ・・・(4) 二酸化硫黄が水に溶けて亜硫酸になる 3H2SO3 → 2H2SO4 + S + H2O ・・・(9) 亜硫酸が硫酸とイオウと水に分解 さらに、 3S + 3H2O → 2H2S + H2SO3 ・・・(10) 上のイオウが高温で水と反応し、硫化水素と亜硫酸をつくる 4H2SO3 → 3H2SO4 + H2S ・・・(11) 上の亜硫酸が硫酸と硫化水素に分解 化学式がいっぱい並んでめまいを起こしそうですが、二酸化硫黄と水だけで出発して、硫酸水溶液(酸性泉)と硫化水素をつくりだすことができました。 ただしこれは、高温で酸素の少ない火山体内部、という特殊環境を想定したものなので、三宅島の噴煙が酸性雨をつくるとか、車や工場の排気ガスで酸性雨ができるっていうような大気中の反応とはまた別です。ちなみにこれは、大気中の水滴(雲)に溶けた二酸化硫黄が亜硫酸になり、これに光があたると硫酸になるっていうメカニズムらしいです。 次回は酸性泉が火山の地下でどうやって作られているかというモデルをご紹介します。 |