| 5 温泉の化学 5-2 水溶液の性質(1) 溶解とイオン 溶けるということ 私たちは日常的に、なにげなく水にいろんなものを溶かして利用しています。 しかし、水に砂糖を溶かすこと、食塩を溶かすこと、炭酸ガスを溶かしてソーダ水をつくること、焼酎を溶かす(割る)こと、せっけんを溶かすこと、これらはすべて同じ「溶ける」現象なのでしょうか? 結論からいうと、せっけん以外はみな溶けているといってかまいません。 化学の用語では、溶ける現象を「溶解」といいます。溶解の定義を理化学事典では、「気体、液体、または個体物質がほかの気体、液体または個体物質と混合して、均一な相の混合物すなわち溶体を生ずる現象をいう」としています。 ここで肝心なのは「均一な」という所で、せっけんがなぜ溶解していると言えないかがこの点にあります。石鹸水は確かに一見すると白色の一様な液体になっていますが、ミクロの目では一種のコロイドであって、均一ではないのです。顕微鏡で覗いてみると、粒子が浮遊しているのがはっきり判ります。同様に、牛乳やマヨネーズ、コーヒーなどもコロイドの一種です。コロイドについてはまた後で、「濁り湯と湯ノ花」の項で詳しくお話しします。 溶解の定義からいうと、物質を溶かしたもの(溶体)は、水溶液以外にもいろいろあって良いことになります。実際に、空気は各種の気体を溶かした溶体であり、合金は個体金属を溶かした溶体です。しかし、あまり広く考えるとややこしくなりますから、ここでは水溶液に限って話を進めることにしましょう。 水(H2O)の構造 たくさんの種類の物質を大量に溶かすことができるという水の性質は、ほかの物質にはない大きな特徴です。この理由を探るために、ミクロの目で見てみましょう。 水の化学式がH2Oと表され、水素原子(H)と酸素原子(O)が2:1の割合で含まれていることはよくご存じのとおりです。ですがどうして常にこの比率は変わらないのでしょう? これは、それぞれの原子がバラバラに散らばっていて、なんとなく2:1の配合になっているのではなくて、H-O-H という分子をつくっていることに理由があります。 水素と酸素が結びつくときには、この形が一番安定な状態なようです。これを原子の電子配置(後述)でみると、水素は電子がもう一個あるといいなと思ってますし、酸素は電子が2個余分だなと思っているので、それぞれが2:1で補いあってしっくりいくようになっているのです。 さて、水分子(H2O)は、H-O-Hという直列配置ではなく、下図のような変な格好をしています。酸素原子を頭にして、2つの腕に水素原子をぶら下げた「やじろべえ」のようなスタイルです。 |
図5-2-1 水分子の形
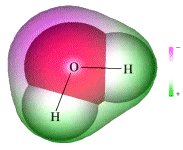
| 図中で原子のまわりをもやのように取り巻いているのは、電子(e-)の軌道がつくる雲(電子雲)です。電子雲の色の違いは、電子の存在度の偏りを表現しています。水分子の全体では電気的な中性になってはいるものの、もともと電子を多くもっていた酸素のほうに電子は存在しやすく、水素のほうにはあまり居ないので、このような偏りができてしまいます。 したがって、やじろべえの頭のほうは負(-)の電荷を帯びやすく、腕のほうは正(+)の電荷を帯びています。このように、分子の方向によって電気的な性質が変化する分子を「極性分子」とよんでいます。この電気的な極性は、イオンのような電荷をもっている物質を強く引きつけて、たくさん溶け込ませるのに役立っています。 |
図5-2-2 水分子の水素結合
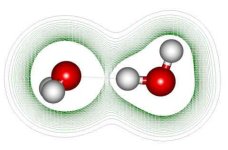
| 水分子の極性は、水分子どうしを結びつけるのにも一役かっています。 上は水分子2個が隣り合ったときにどういうふうになるかを表したイメージです。赤丸は酸素、白丸は水素を示し、一方の分子の水素(+極)ともう一方の分子の酸素(−極)が電気的に引き合っています。この状態を「水素結合」といいますが、引き合う力はふつうの分子間力よりは大きく、このことが、水の沸点がほかの液体にくらべて異常に高いことの原因になっています。 液体中の分子は熱エネルギーを得ると運動が激しくなり、やがて重力に逆らうほどの速度になって飛び出して行きますが、これが沸騰です。水分子の水素結合は、強い力で分子の飛び出しを引き留めるために、沸点が高くなっているのです。他の液体の沸点は、硫化水素H2Sで約-60℃、二酸化炭素CO2では約-79℃、塩化水素HClでは約-85℃と、いずれも非常に低い温度になっています。 では逆に、水の温度を下げていくときには、水素結合はどういう働きがあるでしょう。 |
図5-2-3 氷の結晶の構造
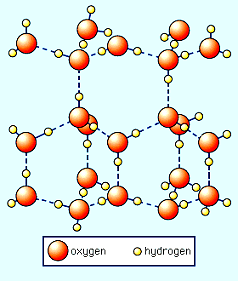
| 上は個体の水、つまり氷の結晶を分子的にみたものです。ここでも水の分子同士は、水素結合で引き合っています。しかし、やじろべえのような形の分子か組み合わさったために、六角形の網目状構造になっています。この六角形の構造は、雪の結晶の形にも反映しています。さて、網目のなかは大きな空洞になっていますね。このために氷の密度は、液体の水よりも小さくなり、個体のほうが液体よりも軽いという妙な現象がおきてしまいます。 液体の水で、H2Oがどういう構造になっているかは、実のところあまりよくわかっていません。どうやら、氷のような規則的な構造と、気体のような分子がばらばらの状態が混在しているようです。最近では、たくさんのH2O分子が集団になって、「クラスター」という状態をつくっているらしいと言われています。 このクラスターが水の性質にどのように関係しているかは、まだ未解明のところが多いので、ここではとりあげませんが、温泉水はふつうの水にくらべて大きいクラスターが多く、氷に近いような状態になっているという報告もあります。このへんが常水と温泉水の根本的な違いかもしれません。今後の研究が待たれます。 イオンとは? 温泉に溶けているものの中で、最も重要なのがイオンです。ではイオンとはいったい何者なのか?、ここで簡単におはなししておきましょう。 原子が、中心にある原子核と、周辺をまわっている電子からできていることはご存じだと思います。この電子の数は、原子の種類によって変わっています。たとえば、水素(H)の電子は1個、ナトリウム(Na)は11個、塩素(Cl)は17個、鉄(Fe)は26個、自然界で一番重い原子のウランとなると92個もの電子を抱えています。 古典的なモデルでは、これらの電子は、原子核のまわりを好き勝手に運動しているのではなく、いくつかの殻にわかれて配置されていることになっていて、内側からそれぞれ、K殻、L殻、M殻というふうによばれています。これらの殻に配置できる電子の最大数はきまっていて、K殻=2個、L殻=8個、M殻=18個というふうになっています。 なんだか会社の組織に似ていますね。社長を原子核だとすると、重役、管理職、平社員の定数がきまっているようなもんです。しかし、理由はよくわかりませんが、M殻より外側では、電子が8個あれば収まりが良くて安定なんだそうです。営業するのに最低限の平社員の数といったところでしょうか。(注:あえて古典的なモデルで説明しているのは、このほうが理解しやすいからです。) とはいっても、原子のもっている電子の数はそれぞれ違うので、安定な電子配置になるにはちょっと足りないのや、余ってしまうのもでてきます。たとえばNaは電子11個なので、内側から電子を配置していくと、K=2、L=8、M=1で、いちばん外側のM殻に電子が1個だけぽつんと入っていることになります。Clは電子17個なので、やはり内側から配置してみると、K=2、L=8、M=7で、もう1個あればM=8で安定になります。 またまた会社組織に例えると、Na社は社員が一人余っていて、Cl社は一人不足しているってことになります。この過不足をうまく解消して人材の有効活用をはかるには、2社が仲良く提携して、Na社が社員を一人Cl社に出向させるのが手っ取り早い方法です。つまり、NaとClがくっついてNaCl(食塩)をつくるのが最も安定な結合(イオン結合)ということです。 このとき、Naは電子(e-)を一個失っていますから、電荷が一つ減ってNa+となっており、Clは電子を一個得てCl-となっています。イオンの右肩に書いてある数字を「イオンの価数」といって、もとの原子よりも電子がいくつ増減しているかを示しています。Na+のような(+)の電荷をもっているものを「陽イオンcation」、Cl-のような(-)の電荷をもっているものを「陰イオンanion」といいます。 さて、原子を水の中に入れてやると、原子の外殻電子は自由に動きまわることができるようになります。こうなるとそれぞれの原子は好きなように電子を放出したり受け取ったり出来ますから、安定な状態になるのは容易なことです。というわけで、水中ではほとんどの原子がイオンになってしまいます。 イオン結合で安定になっていた食塩(NaCl)も、水中ではそれそれバラバラに、Na+やCl-のイオンになったほうが自由がきくので、もはや化合物になっている必要はありません。これが「解離」という現象で、溶けることの一種です。 イオンには、上のNa+やCl-のように単独でイオンになっている「単イオン」のほかに、炭酸水素イオンHCO3-や硫酸イオンSO42-のように、分子の形でイオンになっている「分子イオン」もあります。さらに、錯イオンなんていう複雑なのもありますが、これはまだ取り上げません。 |
図5-2-4 食塩(NaCl)が解離していく様子
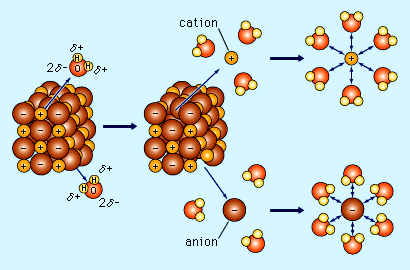
| では水中ではどうしてイオン結合がおこらずに、各イオンがばらばらに存在できるのでしょうか? 言い換えると、どうして水中では解離が起きやすいのでしょうか? これには先の水分子の極性というのが意味をもってきます。 イオンはそれぞれ(+)や(-)の電荷をもっているので、水分子の極性と引きつけあったり反発したりします。その結果、上図のように、イオンのまわりを水分子が囲んで、陽イオンと陰イオンが直接に触れあう機会をなくしていきます(水分子のやじろべえの向きに注目して下さい)。水分子の極性による電荷は、イオンの電荷にくらべるとかなり弱いので、水分子は集団で包囲し、イオンの電荷を打ち消しているのです。こういう状態を、イオンの「水和」といいます。 イオンが解離している水溶液の温度を上げて水を蒸発させてやると、やがて水和に参加できる水分子の数が不足して、イオンの水和が解けます。そうなると陽・陰のイオンどうしが直に接触しあうようになり、イオン化合物ができて結晶となって沈殿するようになります。海水を煮て食塩を作る過程は、この現象の応用です。 このように、陽・陰のイオンがくっついて出来る物質を「塩」といいます、「しお」ではなくて「えん」です。温泉の泉質名に、「硫酸塩」とか「炭酸水素塩」とかついているのは、温泉を煮詰めていくと、こういった塩類ができるよっていう意味です。 気体の溶解 二酸化炭素CO2や硫化水素H2Sなどの気体の溶けかたは、イオンとはまた違っています。基本的に、気体の分子が水中にはいると、水分子の間のすきまにもぐり込んでそのままでいるものと、イオンに解離するものに分かれます。どのくらいの割合で解離するかは、気体の種類によって違ってきます。 CO2を例にとって、これを水中に吹き込んでやると、CO2分子のまま溶け込んでいる「遊離CO2」もありますが。一部は、 CO2 + H2O = HCO3- + H+ というふうに炭酸イオンに解離して、ちょっと酸っぱい「炭酸水」ができます。 水中に溶けている遊離CO2は、水分子のすきまに挟まっているだけなので、温度が上がって水分子の運動が激しくなると、はじきだされて抜け出していってしまいます。これがいわゆる「気の抜けた」という状態です。このとき同時に、上の式の左辺が少なくなりますから、右辺の炭酸イオンの量も減って、酸っぱさも弱くなるわけです。 いっぽうで、圧力を高くしてやると、水に溶ける気体の量はそれに比例して多くなっていきます。炭酸水をつくるときには、うんと高い圧力でガスを吹き込み、強制的に水分子の隙間にCO2を溶け込ませてやっています。これは水にとって迷惑なはなしで、ぎゅう詰めの満員電車のようなもんですから。やがてCO2ははじき出され、泡となって出てきます。 気体の溶解は温泉がつくられるのに大変重要な役目をしていますので、詳しくはまた別項でおはなしします。 [5-2章 参考図書・参考文献] 次回は、わかったようでわからないpHの話です。 |