"Viral load and contact heterogeneity predict SARS-CoV-2 transmission and super-spreading events"
Ashish Goyal, Daniel B Reeves, E Fabian Cardozo-Ojeda, Joshua T Schiffer, and Bryan T Mayer
Goyal et al. eLife 2021;10:e63537. DOI: https://doi.org/10.7554/eLife.63537
received 2020/9/28, published 2021/2/23.
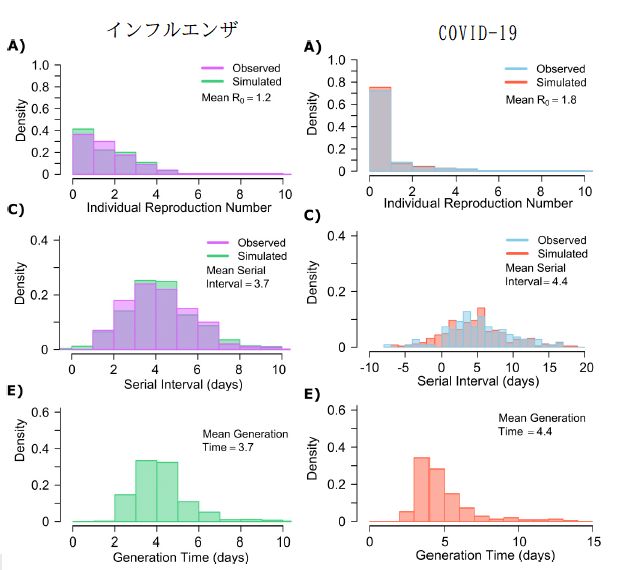
・・・COVID-19 をインフルエンザと比較して、その特徴を明らかにしている。潜伏期間としては、インフルエンザが数日で、バラツキが少ないのに対して、COVID-19は平均して5-6日であるが、そのバラツキが大きい。発症間隔についても同様の傾向がある。発症を起点とした二次感染のタイミングについては、インフルエンザでは1日前から数日の間であり、発症前の感染は10%程度であるのに対して、COVID-19では二次感染のタイミングが発症日で最大となり、発症前の感染が40-50%もある。感染性のバラツキについては大きな違いがある。インフルエンザでは一人の感染者あたりの二次感染者数(再生産数)についてのバラツキはそれほど大きくないが、COVID-19では非常に大きく、大部分の感染者は二次感染をあまり起こさないが、少数の感染者によって多数に二次感染が起きている。これを superspreader と呼ぶ。
・・・この論文では以上の特徴を感染症モデルの視点から考察することで、その違いの理由を推定し、効果的な感染対策を提案している。
重要な結論は、COVID-19の特徴である superspreader 現象は感染力の個人間バラツキの大きさを意味するのではなく、経時的な変化の大きさと感染経路としてのエアロゾル感染(空気感染)の重要性を意味している、という事である。
● 解析手法とモデル(1)体内感染モデルとウイルス排出量の経時変化
・・・基本となるのは、体内における感染モデルである。これは、健常細胞数(S)、ウイルス量(V)、感染細胞数(I)、免疫細胞の活性という4つの要素の間に想定された常微分方程式で記述されている。インフルエンザに対しては、下記の論文のモデルがそのまま適用されている。
"Kinetics of influenza A virus infection in humans"
Baccam P, Beauchemin C, Macken CA, Hayden FG, Perelson AS. 2006.
Journal of Virology 80:7590-7599.
DOI: https://doi.org/10.1128/JVI.01623-05, PMID: 16840338
なお、この論文については解説 を書いたことがあるので、詳しくは述べないが、ここで採用されたパラメータでは著者たちが推奨する感染細胞がウイルスを増殖し始めるタイミングの遅れは取り入れていない。また、使ったデータは1980年の論文からであり、A香港型H1N1インフルエンザを意図的に健常人ボランティアに感染させて測定したものである。他方で、潜伏期間や感染の具体的なデータは2009年の新型インフルエンザH1N1パンデミックの時のものである。全く同じウイルスではないと思われるが、多分大きな違いは無いのであろう。
dS/dt = -βVS
dI/dt = βVS - δI
dV/dt = πI - γV
という単純なモデルである。
β は健常細胞とウイルスが出会ったときに感染する速度定数、
δ はウイルスが不活性化される速度定数(これには液性免疫も含まれる)、
π は感染細胞が新たなウイルスを作り出す速度定数、
γ は感染細胞が死滅する速度定数(これには細胞免疫も含まれる)である。
これらのパラメータは実際に測定される上気道におけるウイルス密度の経時変化を使って決められるが、
感染者毎に大きくばらつくので、期待値(固定効果)とバラツキ(変量効果)がある。
・・・他方COVID-19のウイルス排出量(PCR検査におけるウイルス量)の時間経過はより複雑であるために、免疫作用についての2段階非線形モデルを提案しており、下記の論文で展開されている。ただし、論文自身はレムデシベルとヒドロキシキノンという抗ウイルス薬の投薬タイミングの効果についての予測が目的であったので、より複雑になっている。ここで使っているのは、その論文では基準としている投薬無しの場合である。
"Potency and timing of antiviral therapy as determinants of duration of SARS CoV-2 shedding and intensity of inflammatory response"
Goyal A, Cardozo-Ojeda E, Schiffer J. 2020.
medRxiv. DOI: https://doi.org/10.1101/2020.04.10.20061325
一応式を書いておく。
dS/dt = -βVS
dI/dt = βVS - δ(I^k)I - m{E^r/(E^r + Φ^r}I
dV/dt = πI - γV
dM1/dt = ωIM1 - qM1
dM2/dt = q(M1 - M2)
dE/dt = qM2 - δe E
M1、M2、E は免疫細胞数であり、E が獲得免疫作用を行うT細胞数である。
自然免疫作用の項 δ(I^k)I 共々に非線形となっている。
感染してウイルス量がピークを越える辺りまではインフルエンザと同じであるが、その後で、プラトーの部分が生じるところを合わせるために入れた項である。この項の形式がどれくらい生理学的根拠を持つのかについては、僕にはよく判らない。
パラメータ数はインフルエンザの場合よりも増えている。このパラメータについても実際のウイルス量を再現するように、期待値とバラツキを決めている。
実際上必要なのはウイルス量の経時変化であるから、体内のメカニズムまで論じないのであれば、ウイルス量を表現するような、パラメータを含む数式さえあれば良いと思われる。以下は論文の図である。モデルの図と個別感染者毎のグラフである。横軸は発症日からの経過日数で、縦軸がウイルス検出量、点々が実測で、曲線がモデル計算である。
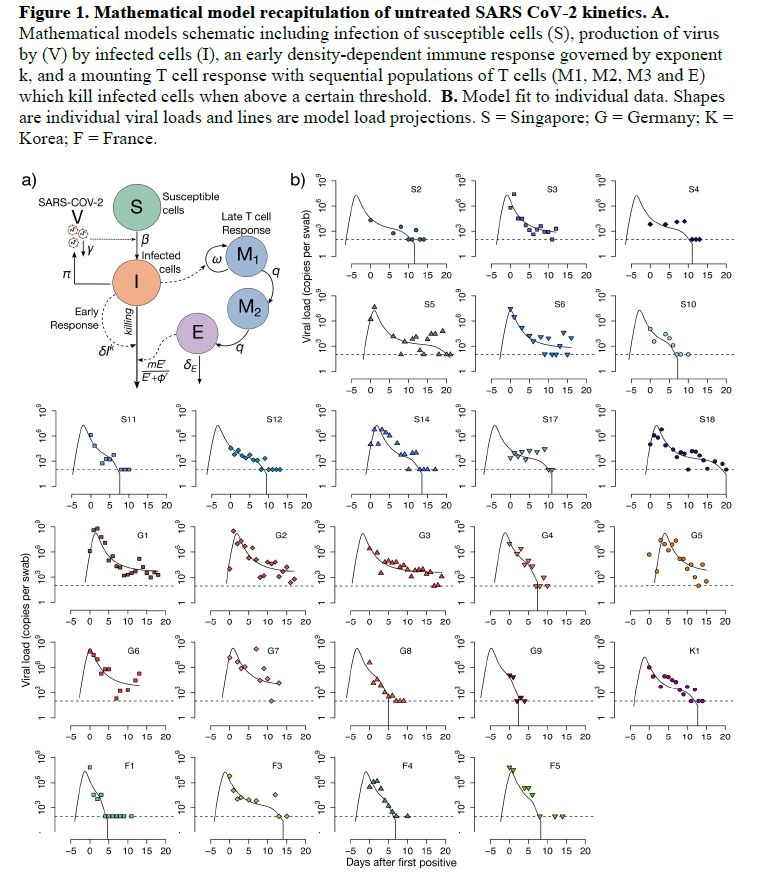
● 解析手法とモデル(2)ウイルス量と感染力の関係
・・・モデルとしての次の要素は、ウイルス量と感染力の関係である。ここでやや判りにくい用語が登場する。contagiousness(伝染性)CD は、感染者の空気流路から被感染者の空気流路へとウイルスを含む粒子が運ばれていく確率と定義されている。infectiousness(感染性)ID は、ウイルスに暴露された空気流路から直接的にウイルスが被感染者に transmission(伝送)される確率と定義されている。transmission risk というのはこれらの積で表されていて、感染者から二次感染者への感染リスク TD である。これらは勿論感染が可能な接触(距離や接触時間)の元において、である。それらの確率は感染者の発するウイルス量に依存するから、その曲線を dose-response(用量反応)曲線と呼ぶ。それらの確率が半分になるようなウイルス量を、それぞれ、CD50、ID50、TD50 と定義している。これらの値とそのウイルス量における曲線の傾きがパラメータとなる。(曲線の関数形は固定される。)この容量反応曲線は感染のメカニズムと考えられていて、単純化するために個人個人のバラツキを想定していない。感染のバラツキは感染者のウイルス量のバラツキや時間変化と被感染者の体内でのウイルス増殖経過のバラツキ(パラメータのバラツキ)に帰されている。
● 解析手法をモデル(3)接触頻度
・・・感染者と被感染者が感染可能な接触(exposure contact)を行う頻度についてはガンマ分布で表現する。期待値は一日あたりの接触回数 θ で、その変動パラメータが ρ である。この分布から確率的に exposure contact を与える。
● 解析手法とモデル(4)全体最適化
・・・それぞれの exposure contact の度に、感染者に対して、確率的に選択された体内感染プロセスパラメータによるその時点でのウイルス発現量が計算され、transmission risk の曲線(TD曲線)に当てはめて二次感染の確率が計算される。感染が成立すると、そこから τ 日だけ経過した後に最初のウイルス生産が始まる。あとはこの繰り返しとなる。
・・・潜伏期間の分布については文献を使う。これもガンマ関数であり、そこから確率的に感染者と被感染者の潜伏期間を選択すると、発症間隔=(二次感染者の潜伏期間) + (世代時間) - (一次感染者の潜伏期間)が得られる。世代時間= (二次感染者の感染日) - (一次感染者の感染日) である。
・・・TD曲線は 256種、パラメータセットは 417792 種を想定し、接触頻度分布については θ と ρ の組を408通り、τ については 0.5、1、2、3 日 を想定し、それらの全てのパラメータセットにおいて、確率的に多数の計算を行う。計算するのは、個人間の平均 R0 の分布、発症間隔の分布、R0 の積算分布、発症間隔の積算分布である。これらの実測値分布をもっともよく再現するようなパラメータセットを推定する。かなりな力業である。具体的なやり方と最適パラメータ値は Materials and method に記述されている。ここには書かない。ただ、COVID-19 での γ の記述が見当たらないようである。どうやら γ は c へと記号が変更されていて、その変更が徹底していないようである。
● パラメータ最適化によるデータの再現
・・・実際のデータと最適パラメータにおける計算された値との比較は、インフルエンザについては Fig.6、COVID-19については Fig.2 に図示されているので、これらをまとめて以下に示す。
● 容量反応曲線と感染のタイミング分布
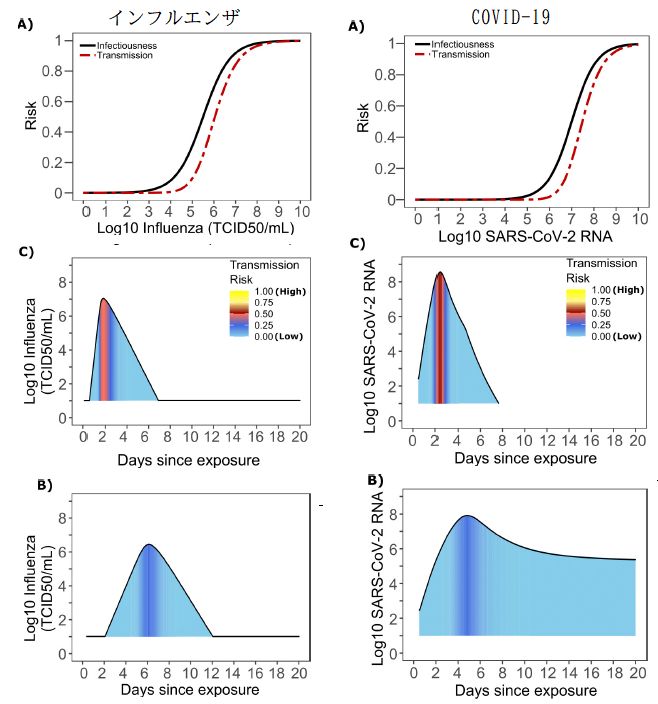
・・・感染者によるウイルス排出の経時変化についての確率分布が決まるので、実際の感染がどこで起きたかというデータを再現するように、容量反応曲線が決まる。どの程度の確度があるのか?については僕にはよく判断できないが、インフルエンザについては Fig.7 に、COVID-19については Fig.3 に図示されている。
・・・この感染曲線は結構シャープなので、感染の起こるタイミングはウイルス排出量の最大値の近辺に限られることになる。典型的なウイルス排出量経時変化の上に感染頻度を色分けで表示した図(ヒートマップ)も示されているので、まとめて以下に示しておく。
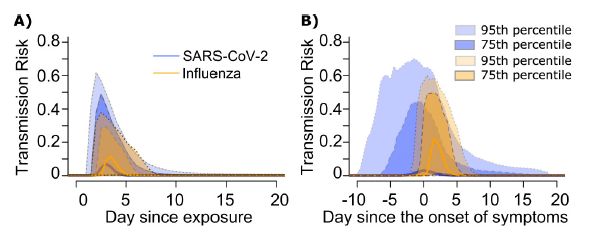
感染者と非感染者が感染可能な接触をしたときに、どれくらいの確率で二次感染が起きるか、というのが transmission risk であり、その接触のタイミングによって異なる。下図(Fig.9 A,B)は、一次感染者の感染日起点での transmission risk (左側)と 一次感染者の発症日起点での transmission risk (右側)を図示したものである。太い実線が判りにくいが、risk の期待値である。risk はその時の一次感染者のウイルス排出量によって異なるのであるから、接触タイミング毎に risk 自身がばらついていて分布を持っている。面で色分けされているのは、その分布が 75%となる risk 範囲と 95%となる risk 範囲である。期待値については、インフルエンザの方がCOVID-19よりも大きくて、タイミングとしては遅くなっているが、risk の75%と95%範囲についてはCOVID-19の方が広い。つまり、risk の大きさのバラツキも大きくて、感染タイミングのバラツキも大きい。また発症日を起点として見た場合(右側)COVID-19では発症日以前における risk が大きい。このタイミング分布としての拡がりは主として潜伏期間の大きなバラツキに由来する。ただ、やや実態よりは発症日以前の risk の比率が高い結果となっている。
・・・注意すべきは、このようなパラメータ最適化に使ったデータは、各国でさまざまな対策が取られて人々がかなり警戒するようになった後であるということである。初期武漢においては感染対策が間に合わなかった為に、その頃のデータを使うと違う結果になる。その比較が Fig.5 に図示されている。感染の容量反応曲線はより低いウイルス量での感染が起きるようになっていて、それを反映して二次感染の期間も長くなる。
● 考察
・・・この計算モデルは現実のデータを再現するように作られたものなので、データから直接言える特徴が再現されるのは当たり前である。しかし、計算モデルによって、その特徴が何に由来するのか、という事が判る。
・・・ウイルスの排出プロファイルは、COVID-19 の方がやや遅く始まり、長く尾を引くという違いがあるが、二次感染を生じる期間は2-3日位であまり変わらない。プロファイル自身の違いとそれに付随して潜伏期間が長くてバラツキが大きいというCOVID-19の特徴は免疫反応の遅れに起因する。結果的には、二次感染が起きていても発症していない、という状況の割合が高くなる。ただし、この計算ではそれが誇張された結果になっている。発症前感染の比率が、インフルエンザでは 10%、COVID-19では 62%となっている。実際にはCOVID-19では40-50%程度である。これは潜伏期間の長さに応じたウイルス排出量ピークの遅れが 充分考慮されていないからである。具体的には、おそらくパラメータ τ に分布を与えていないからだろう。
・・・COVID-19のもう一つの重要な特徴は少数の感染者が大部分の二次感染を引き起こす、という superspreader 現象である。ただ、ウイルス排出量が極端に大きな感染者が居る訳ではない。つまり、superspreader 現象の原因は接触パターンの方に帰すしかない。しかし、接触につながる行動パターンそのものは感染症の種類とは関係ない。同じような行動パターンでありながら、なぜCOVID-19では superspreader 現象が生じるのか?論理的に考えて想定される唯一の答えは、感染範囲の広さしかない。一人の感染者の周辺に同じように非感染者が集まっていたとしても、インフルエンザよりもCOVID-19の方が多数に感染させる。平均すると再生産数が変わるわけではないのだから、他方で全く感染させない場合も多いことになる。このようなことが生じるのは、感染者が二次感染を生み出すだけのウイルス量を排出する期間が短くて、たまたまそのような時に周囲に多数の非感染者が居た、という状況があるからである。つまり、感染を引き起こす物理的な範囲が広いのである。これは飛沫感染だけでなくて、エアロゾル感染(空気感染)が起きているからとしか考えられない。
・・・COVID-19では当初空気感染は考えなくてよいということになっていた。しかしこの論文は空気感染を考慮しないと superspreader 現象が説明できなくなる、ということを述べている。昨年の9月段階で病理と疫学データだけでこれを明確に述べたというのは素晴らしいと思う。なお、インフルエンザでは空気感染が起きないということではない。あくまでも相対比較の話である。 (空気感染と飛沫感染はウイルスを含む粒子サイズの差で、一般的には5ミクロン以下(エアロゾル)となり微粒子としての浮遊時間が長い(3時間以上)場合が空気感染とされている。)