◆エンドトキシンとは?
エンドトキシン(内毒素、endotoxin)の化学的本体ははグラム陰性菌細胞壁の構成成分であるリポ多糖(lipopolysaccharide;LPS)であり、非常に多くの生物活性を示す。細菌を培養したとき濾液に検出される蛋白性毒素、即ち菌体外に分泌される毒素である外毒素exotoxinに対して、菌が死ぬまでは菌体にとどまることから定義された。内毒素、エンドトキシン、リポ7多糖、リポポリサッカライドは同義語であり、このサイトではエンドトキシンあるいはLPSを 好んで用いる。また、省略形としてET、Et、Edtなどが用いられる。
エンドトキシン(endotoxin)という名が文献上に現れるのは 1892年(明治25年)で、Pfeifferがコレラ菌(1883年にKochによって発見された)の耐熱性毒素について菌体に由来するものとして命名 した。かの詩人で科学者の宮沢賢治が誕生する4年前のことである。
→エンドトキシン研究の黎明期は宮沢賢治の生きた時代だった
◆エンドトキシンはグラム陰性菌細胞壁を構成する
エンドトキシンは殆ど全てのグラム陰性菌と若干の光合成細菌が持っている。エンド トキシンは菌の最表層(外膜)にあり、リピドA部分が外膜内層のリン脂質層(おもにフォスファチジルエタノールアミン)と疎水結合して、脂質2重層(外 膜)を形成している。エンドトキシン分のリン酸基の陰イオンがMg++などの2価の陽イオンを介して互いに結合している。外膜には 20種ほどの外膜蛋白質が存在し、そのうちいくつかは外膜を貫通している。これらには外膜の透過孔を形成しているポーリン蛋白や、何種類かのファージ受容 体、鉄やビタミンなどの輸送蛋白、ペプチドグリカン結合リポ蛋白などがある。
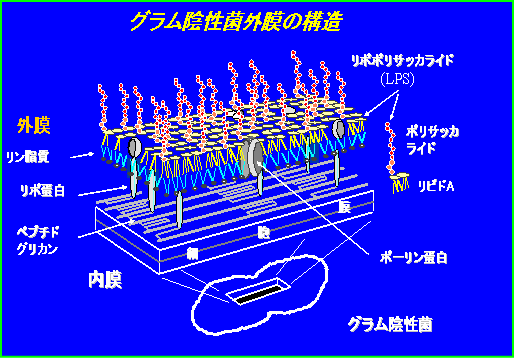 |
図1 グラム陰性菌外膜の構造 |
また、外膜には腸内細菌科に共通の抗原(ECA)や、莢膜多糖が存在する。これらはリン脂質をもち、エンドトキシンと同様に内側のリン脂質層と疎水結合し ている。ECAは菌株によってはRコアの末端にO側鎖のかわりに結合している。ECAもエンドトキシンと同様にマイトジェン活性や多クローン性B細胞活性 化作用をもっている。ECAのマイトジェン活性はエンドトキシン不応答性のC3H/HeJマウスでもみられ、リムルステスト活性はなく、発熱性や致死活性 はエンドトキシンと比べてかなり弱い。
外膜の内側には一層のペプチドグリカン層があり、菌の形を保つのに働いている。エンドトキシンは細胞質膜(内膜)で合成され、内膜とペプチドグリカン層の間(ペリプラスム間隙)を通過して外膜に移動する。
◆エンドトキシンの構造
サルモネラや大腸菌などの腸内細菌科Enterobacteriaceaeや、緑膿菌とその仲間であるPseudomonadaceaeの LPSは、O(オー)特異側鎖、外部コア、内部コアと、リピドAで構成されている。リピドAはNアセチルグルコサミン(GlcN)のニ糖と水酸化脂肪酸と の複合体であり、エンドトキシンの生物活性を担っている。淋菌などではO特異側鎖を持たず外部コアと内部コアとリピドAで構成され、特にLOS(リポオリ ゴサッカライド)と呼ばれている。クラミディアのエンドトキシンは内部コアとリピドAで構成されている。
大腸菌などのLPSでもO側鎖多糖やさらにコア多糖を欠損する変異株があり、親株のコロニーの辺縁が滑らか(S型)なのに対して変異株のコロニーは粗面(R型)なので、それぞれのLPSはS型LPS、R型LPSと呼ばれる。
O特異側鎖の繰り返し単位の糖組成によって抗原性が決定されO(オー)抗原と呼ばれ、大腸菌ではO抗原の種類から百数十種類に分類される。例えば157大腸菌O157は腸管出血性大腸菌の代表的なものである。
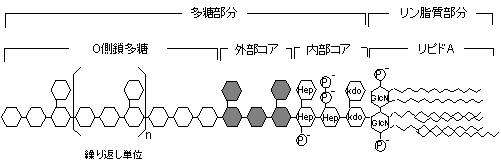 |
図2 LPS の構造 |
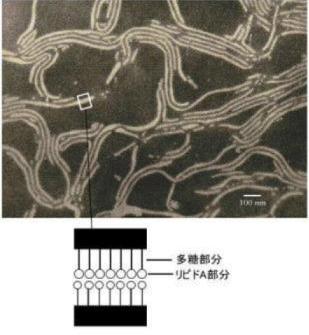 |
図3 LPSの電子顕微鏡写真 大腸菌K39から得たWestphal型エンドトキシン(後述)を陰性染色し電子顕微鏡で観察した。ひも状のミセル構造が見れる。両親媒性 のLPSは、二本の長いLPS分子が互いに疎水性部分で結合し外側は親水基と考えられている。LPSは一般には水には溶解出来ず超音波処理などで縣濁させ る。 |
◆リピドAの構造
1950年代、当時エンドトキシン研究のメッカであったマックス・プランク免疫生 物学研究所(フライブルグ、ドイツ)のWestphal、Lüderitzらはエンドトキシンの活性本体はリピドAであるとし、その推定構造を明らかにした。現在わかっている構造のうちKDOの結合部位が3’位でなく6’位の水酸基にである以外は正しかった。リポ多糖から酸でリピドAを分離した 化学的には純粋ではない標品について分析したことから酸に不安定なKDO、リン酸、エタノ-ルアミンなどの結合様式は推定する以外になかったのである。
1980年代に芝、楠本らのグループは彼らの卓越した有機合成化学の技術を駆使してサルモネラ型リピドAを合成した。最初にグルコサミン ニ糖の基本骨格に1または4’位にリン酸基を付与したり、3,4位と6’位の酸素にO-アシル結合でヒドロキシ脂肪酸を結合させたり、2,2’位のアミノ 基に同様の脂肪酸あるいは、枝別れ脂肪酸を結合させたものを合成した(300番代合成アナログ)。しかし、これらの殆どはエンドトキシンのもつ発熱活性、 致死活性、リムルス活性を示さないか、あってもきわめて弱かった。このようにWestphalらの推定した構造を再現してもエンドトキシンの活性が得られ なかったことからその推定構造に誤りがあるためではないかと考えられるようになった。
1982年に同グループは大腸菌リピドAを高度に精製してNMR解析し、KDOの結合位置が非還元末端の3’位ではなく、6’位であ ることを明らかにした。ほぼ同時に、RietschelらもサルモネラリピドAで同様のことを見いだした。また、LehmanらもリピドA生合成中間体の 構造を明かにし、いずれも推定構造の誤りを指摘した。
芝、楠本らは早速1位または4’位にリン酸がついた4つのヒドロキシ脂肪酸の結合した400番代と、2’、3’位の脂肪酸はダブルアシル脂肪酸である 500番代の合成リピドAを作成した。そして多くの研究者の協力による構造活性相関の研究が行われた結果、これらの合成リピドAは天然のリピドAと同等のエンドトキシン活性をもつことが証明された。
リピドAは多くの細菌でβ-1,6-ジグルコサミン骨格をもち、それに種々の長さの脂肪酸、およびリン酸などが結合した物質で、脂肪酸はエンドトキシンに 特異的なβ-、もしくはα-ヒドロキシ酸を含んでいるのが特徴である。さらにβ-1,6-ジグルコサミン骨格の1位および4’位がリン酸化され、2位,3 位,2’および3’位がアシル化されたものである。大腸菌では2,3位に結合するアシル基は炭素鎖長が14(C14)でβ位に水酸基をもつβ-ヒドロキシ ミリスチン基であり、2’位にはC12アシル基をβ位側鎖としてもつC14アシル基が結合している。3’位にはC14アシル基をβ位側鎖として持つC14 アシル基が結合している。LPSの場合は6’位の酸素はコア多糖の末端に存在するKDOと結合しているが、酸加水分解するとこの結合が切れ、6’位に水酸 基を持ったリピドAが遊離する。
エンドトキシンはきわめて多彩な生物活性をもつが、その殆ど全てはリピドAが担っている(例外的に補体の別経路の活性化は多糖部分が担っている)。合成リ ピドA標品を用いた研究から、生物活性のリピドAの構造要求性が明確になった。シュワルツマン反応発現には最も構造要求性が高く、脂肪酸の結合位置が重要 であり、アシロキシアシル脂肪酸とリン酸が必須である。致死活性発現にはアシロキシアシル脂肪酸の存在は必ずしも必要としないが、B細胞活性化活性やイン ターフェロン誘導活性などでは比較的構造要求性が低い。
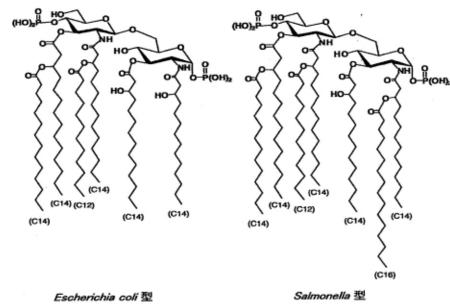 |
図4 大腸菌型およびサルモネラ属菌のリピドAの構造 |
◆常在菌や慢性炎症をおこす菌のもつエンドトキシンは活性が弱い
グルコサミンニ糖に結合している脂肪酸の数や脂肪酸の炭素数、リン酸基の数が生物活性に大きく影響する。腸管内の主要な常在菌Bacteroides、歯周病の原因であるPorphyromonas (以前はBacteroidesに分類されていた)、加齢とともに胃粘膜での保有率が高まるピロリ菌(Helicobacter pylori) などは典型的な構造を持たず(図5)、サルモネラや大腸菌の生物活性の1/100以下と報告されている。例えば、ピロリ菌LPSは発熱活性、致死活性が大腸菌 LPSのそれぞれ1/1000以下、1/500である(天野憲一,日本細菌学会雑誌 56:421-33,2001)。ヒトは進化の過程で弱毒のエンド トキシンを保有すようになったとも考えられ、興味深い。
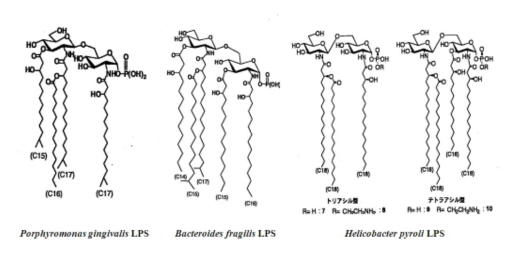 |
図5 常在菌等のリピドAの構造 PorphyromonasとBacteroidesの構造は小川知彦の総説(日本細菌学雑誌 61:391-404,2006)から引用した。Porphyromonas gingivalisのLPSには、このテトラアシル型のほか、トリアシル型、ペンタアシル型などがある。Helicobacter pyroliの構造は上述の天野憲一の総説から引用した。 |
◆エンドトキシンの抽出法
エンドトキシンの主な抽出法にはTCA抽出法とフェノール・水抽出法がある。
a. TCA抽出法
原法はBoivin、Mesrobeanuらによって報告された。この方法で抽出 されたエンドトキシンはBoivin型エンドトキシンまたはBoivin抗原と呼ばれる。冷水中に浮遊させた細菌に等量の冷トリクロル酸TCA水溶液液を加えて3時間 振盪抽出する。4℃で遠心し、上清からエタノール沈澱でエンドトキシンを得る。この方法は比較的温和な抽出法であり、タンパク質が10~20%含まれる。
b.フェノール・水抽出法
Westphalらが考案したので、Westphal法と呼ばれ、この方法で得たものはWestphal型エンドトキシンという。外膜成分であるタンパク質およびリン脂質とLPSの結合を解離し、できるだけ選択的にエンドトキシンを抽 出する目的にあった方法であるといわれている。菌体はフェノール-水の加温処理によって破壊され、リポ多糖は核酸や多糖体などの水溶性成分とともに水層に 移行する。冷フェノール・水抽出法と温フェノール・水抽出法があるが、後者が蛋白質量の少ないLPSが分離できるので常法になっている。水に浮遊させた菌体に同量の90%フェノールを加えて68℃で10~15分抽出し、氷冷後遠心して上層(水層)と下層(菌体残査を含む含水フェノール層)を分離する。水層を透析、濃縮、凍結乾燥する。この方法でもしかし、2価金属イオン、ポリアミン、蛋白質、多量の核酸等を含んでいるので、さらに超遠心等で精製する必要があ る。市販のWestphal型エンドトキシンには精製されたものもある。
この他、変異型であるR型LPSの抽出法であるフェノール・クロロホルム・石油エーテル(PCP)抽出法がある(Galanosらが開発した)。予めエタ ノール、アセトン、エーテルでそれぞれ洗浄脱脂したR型乾燥菌体を液体フェノール(90 g+水11 ml)、クロロホルムおよび石油エーテル(2:5:8) から成る混合溶媒で2~3回抽出し、5,000×gの遠心上清を合わせて減圧下溶媒を留去する。フェノールを含有する残査に水を滴下し、生成する沈澱を 80%フェノール、エーテルで順次洗浄後減圧乾燥する。さらに超遠心精製する。PCP法は一般にS型LPS、蛋白質、核酸、グルカンは溶かさないので純度の高いR型LPSを分離できる。
*エンドトキシン標品の懸濁法
1~10 mg/mlにエンドトキシンフリーのPBS、生食水、水などに縣濁し、超音波発生器のチップを溶液内に挿入して数分間処理する。塊がなくなるまで根気よく行う。やや不透明な状態に縣濁される。細胞に用いる場合には80℃以上10分程度加熱する。少量に小分けして-80℃に保存し、用時希釈して用いる。エンドトキシンフリーのヒト血清アルブミン0.2%液で希釈しておくと壁への吸着が原因と考えられる力価低下がなく長期間保存可能である。
参考図書
細菌内毒素、本間遜他編、講談社サイエンティフィク、1973
内毒素ーその構造と活性、本間遜他編、医歯薬出版、1983
エンドトキシン、新しい治療・診断・検査、中野昌康・小玉正智編、講談社サイエンティフィク、1995
エンドトキシンと病態、遠藤重厚、稲田捷也、へるす出版、1995