


|

ここに記載されている内容の多くは、一般的なエンドトキシンおよびその周辺についての記述とは異なっていると考えられるが、著者の考え方であることを了解下さい。
なお、このサイトの他の部分の記述と一部重複する。
-目 次-
1. 欧米のエンドトキシン定量法との決定的違い
2. エンドトキシンを常に抱える生体
3. 腸管からのエンドトキシンの血中への侵入経路
4. エンドトキシンの認識機構;TRL4とともに補体も重要
5. エンドトキシン結合タンパクに守られている生体
6. 感染症における外毒素とエンドトキシンに対する生体防御反応の違い
7. 二次生体反応とcytokine flood
8. エンドトキシン反応の場
9. エンドトキシン中和物質ポリミキシンBとFactorC
10.エンドトキシンアクティビティーアッセイ(EAA)は何を測定しているか?New
11.抗生物質によるエンドトキシンリリースNew
12. Bacterial translocationの真実New
13.喘息とエンドトキシンの関係はある?New
1.欧米のエンドトキシン定量法との決定的違い
リムルステストが血中エンドトキシンを直接測定する唯一の方法である。日本にはエンドトキシンに特異的な方法がすでに25年前からあり、血中エンドトキシンはグ
ラム陰性菌による敗血症や敗血症性ショックでのみ陽性になることがわかっている。
しかし、欧米ではいまでもエンドトキシンに非特異的な方法を用いている(最近FDAは和光の特異試薬の製造を承認したので近い将来血液エンドトキシンの定量にも特異試薬が一般に使用される時が来よう)。欧米の論文ではエン
ドトキシン、グルカン、さらに時にはグルカン様物質をトータルで測定した成績をもとにして感染症以外の病態についてエンドトキシンとの関係を考察している。これらの場合エンドトキシン以外の要因(深在性真菌感染症、セルロース膜透析、肝疾患、人工心肺、など)、で陽性になるにもかかわらず、エンドトキシンは血中に容易に侵入し、エンドトキシンは多くの病態に関与するなどとの間違った結論が誘導される。
→リムルステストに詳述
今後エンドトキシン特異的測定法という同じ土俵で欧米の研究者と理解を深めていく必要がある。
2.エンドトキシンを常に抱える生体
生後まもなく定着するエンドトキシン保有細菌のエンドトキシンに我々は常に晒されている。成人の腸管内エンドトキシン量は25-30gといわれている。しかし、腸管内の主要な常在菌Bacteroides(菌数は大腸菌の1000倍多い)、口腔内の歯周病の原因であるPorphyromonas (以前は Bacteroidesに分類されていた)、加齢とともに胃粘膜での保有率が高まるピロリ菌(Helicobacter pylori)などはLPS の典型的な構造を持たず、その生物活性はサルモネラや大腸菌の1/100以下であるという。進化の過程で強毒エンドトキシン保有細菌をもつヒトは淘汰されて、弱毒エンドトキシン
保有菌をもつようになったのだろうかと著者は考える。
→エンドトキシンとは?に詳述
3.腸管からのエンドトキシンの血中への侵入経路
腸管のエンドトキシンは昔から門脈を通って肝臓にはいりそこで解毒されると考えられて来た。これは従来のエンドトキシン非特異的定量法では門脈血で陽性を示すことからこの考えができた。しかし、腸管結紮ループにエンドトキシンを注入する実験では、エンドトキシン特異リムルス試薬を用いると門脈からはエンドトキシンは検出できない。ところが所属リンパ節のリンパ液からエンドトキシンが検出された。しかしリンパ管が集合した胸管が静脈に注ぐ部位や末梢血では殆ど検出されない(菊池 充、渡辺正敏:腸管内エンドトキシンの血中への侵入径路としてのリンパ系について─イヌ、腸管結紮ループ法を用いた実験的検討─ 日本消化器外科学会雑誌 26:68-75,1993)。
従って腸管のエンドトキシンはリンパに入りリンパ液中で解毒されると考えられる。リンパ液、リンパ節にエンドトキシンを解毒さ せる機構があると考えられる。腸管のエンドトキシンはリンパがバリアになって血中にはなかなか入りずらいということになる。
健常者でも微量のエンドトキシンがリンパに侵入している可能性がある。そしてエンドトキシンは僅マクロファージや樹状細胞を活性化し、生体の活性化に寄与していると考え られる。
大量のエンドトキシンがリンパに入って解毒しきれずに胸管から血中にあふれ出ると最初にエンドトキシンが入る臓器は肝臓でなく肺であると考えられる。
肝臓でのエンドトキシン解毒説は否定的である。
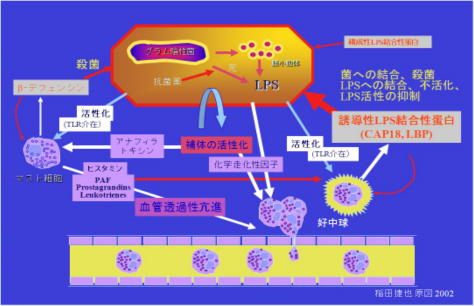
4.感染症におけるエンドトキシンの認識機構;TLR4とともに補体も重要
エンドトキシン受容体であるトール様受容体4(TLR-4)がグラム陰性菌感染に対する防御の中心的役割をしている(TLR4ノックアウトマウスはグラム
陰性菌の感染症になりやすい)。しかしこれが感染防御の機序のすべてではない。補体がもう一つの防御機構として重要である。
細菌の細胞壁成分により補体の二次経路やレクチン経路が活性化されるといずれの場合でも、C3からC9までのカスケード反応が次々と進行する。最終的に活
性化補体成分が集合して膜侵襲複合体が作られ、細菌表面に陥入し、細菌を死滅へと導く。
またカスケード反応の途上で産生される白血球遊走因子は血管から白血球を感染巣に集積させる。さらにアナフィラトキシンはマスト細胞の脱顆粒を引き起こしヒスタミンを放出させる。ヒスタミンは血管透過性亢進をもたらし、白血球集積を助長する。
また、活性化補体の一部であるC3bは細菌表層に結合し、細菌・C3b複合体は白血球のC3b受容体に結合し効率よく取り込まれる。これに よって白球球は活性化され炎症性サイトカインが産生され炎症反応が惹起される。
TLR4による認識と補体活性化の両機構は互いに補完しあいながら働いていると考えられる。
なお、この機構は腸管からリンパに入るエンドトキシンに対して、解毒(白血球への取り込み)の機作としても働いていると考えられる。
5.エンドトキシン結合タンパクに守られている生体
TLR4による認識と補体活性化の両機構に加えて、もう一つの防御機構は好中球由来の抗菌物質である。
好中球顆粒のBPIやデフェンシン、CAPなどの抗菌蛋白は、好中球は感染があるとその局所に集合し食菌脱顆粒によって放出される。なかでもBPIやCAPはエンドトキシンと強く結合し不活化する。
感染時にはエンドトキシン量も増加するが好中球はどんどんその局所に集積するので、結果的にエンドトキシンの不活化も活発におこる。なお、エンドトキシンは結合蛋白との特異的な結合以外に、多くの蛋白と非特異的に結合する(多くは疎水性結合)。アルブミンなどは通常エンドトキシンが結合していると考えられてい
る。
6.感染症における外毒素と内毒素(エンドトキシン)に対する生体防御反応の違い
外毒素は細菌が産生分泌する強力な活性を持った蛋白性の毒素である。生体の防御機構としては抗体のみといってよい。そもそも外毒素を産生する菌は外から生体を攻撃するものである。生体は一度はそれに攻撃され強い障害や死を招くが、それに耐えて抗体を産生し、二度目の攻撃に備える。
一方エンドトキシンの場合は、その活性部位であるリピドAに対する抗体は産生され難く、エンドトキシンに対する防御は抗体では説明し難い。
エンドトキシンに対する防御には腸管内常在菌の持つエンドトキシンに対する平時の防御機構(リンパ=3で述べた)と、細菌感染が起こったときに主に感染局所で対処する防御機構(TLR4、補体、結合タンパク)であると考えられる。
上述したように生体はエンドトキシンに対する二重三重の抵抗手段を兼ね備えている。生体内にエンドトキシンを抱えているから、これに対処するよう強固な防御機構を構築しながら我々は進化してきたと推定される。外から攻撃する外毒素に対する単純な防御機構(抗体)とは大いに異なる。
7.二次生体反応とcytokine flood
敗血症(感染性SIRS)では、血中サイトカイン濃度は高値を呈する。さらに敗血症性ショックでは特定のサイトカイン値がさらに上昇する。我々はこれらのサイ
トカインは感染局所由来であると推定してきた。一方で敗血症性ショックでは血中白血球のサイトカイン産生能が亢進している可能性、あるいはエンドトキシン
に対する反応性が亢進しているのではないかとも考えてきた(かって二次エンドトキシン反応という造語を作った;著書「エンドトキシンと病態」)。そこで末梢血
培養でのエンドトキシンや菌体刺激(E.coli、S.aureus加熱死菌)などに対するサイトカイン産生能について検討した。その結果敗血症や敗血症性 ショックでは意外にもTNF-α、IL-6、IL-10、IFN-γなどのサイトカイン産生能が健常者に比較して著しく低下していることがわかった。一方
で、IL-8などのサイトカイン産生や顆粒球エラスターゼの分泌は健常者と同等か、亢進していることがわかった。
このことから、
1)敗血症(敗血症性ショックでも)ではエンドトキシンや菌体刺激に対してのサイトカイン産生性が健常者と全く異なることがわかった。これを著者は二次生
体反応と呼ぶことにした。かって考えた二次エンドトキシン反応とは異なる生体反応である。
2)高値の血中サイトカインは血中で造られるのではなく、感染(炎症)局所でつくられ血中にに溢れ出る。これをcytokine floodと呼ぶことにした。血中に出現する因子が二次生体反応を支配していると考えられる。
いきなりエンドトキシンを投与するときにおこる反応は一次生体反応であり、エンドトキシンを静注する動物実験がこれにあたる。従って二次生体反応がおこっている状態の動物実験モデルを用いてエンドトキシンの研究をすべきと考える。
感染症は熱傷や外傷等でエンドトキシンが血中に侵入するとき(すでにほとんどのエンドトキシンは結合蛋白で何らかの修飾を得てると考えられるが)、エンドト キシンにたいして健常者とは異なる反応が惹起される。IL-8は好中球を活性化し、IL-1raは好中球からよく産生されるから、SIRSでは顆粒球が活 性化されていることが示唆される。これがショックや多臓器不全につながると考えられる。
8.エンドトキシン反応の場
以上のように、エンドトキシンに対する防御網は非常に厳しく、反応するにしてもその主な”場”は感染局所やリンパ節などであると考えられる。エンドトキシ
ンには好中球やマクロファージなどの細胞や結合タンパクが集まって来て、エンドトキシンは血中に入る前にすでに局所で働いていると考えると興味深い。
生体内ではエンドトキシンは常に結合蛋白に包囲されていると考えられる。生体内でグラム陰性菌の表層にあるエンドトキシンにはすでに種々の結合蛋白が結合しているだろう。抗菌性の結合蛋白と結合した菌は死滅する。
LBPと結合したエンドトキシンは、マクロファージや顆粒球に結合し活性化させる。
エンドトキシンは感染局所で作用し、サイトカインを産生する。一部のサイトカインは血中に横溢する。
血中には蛋白が結合したエンドトキシンが入ると考えられる。そしてその一部はリムルステストで測定される。
リムルスのC因子のエンドトキシンに対する結合力は相当強いと考えられ、C因子は蛋白と結合しているエンドトキシンに競合的に結合し、リムルスカスケード反応が惹起される。
(図;2010/03/06修正)
9.エンドトキシン中和物質ポリミキシンBとfactorC
ポリミキシンBはBacillus polymyxa(グラム陽性桿菌)からとられた環状のペプチド系抗生物質で、グラム陰性菌に対する強い抗菌活性を示す。
ポリミキシンBのペプチド部分が菌体表層のリポ多糖(エンドトキシン)に結合し、膜を撹乱し、その脂肪酸部分が膜の疎水部分と結合し膜を破壊する。
ポリミキシンBはエンドトキシン活性を抑制することから、ある物質の生物活性が汚染したエンドトキシンによることを否定するためによく用いられる。エンド
トキシンと重量比で数倍から100倍程度の量で殆どのエンドトキシン活性を抑制できる。しかし、エンドトキシンのリムルス活性だけは10万から100万倍
必要である。このことは、リムルスのC因子とエンドトキシンとの結合力がポりミキシンBのそれに比較してはるかに強いことを示している。
10.エンドトキシンアクティビティアッセイ(EAA)は何を測定しているか?
全血に抗LPSマウスIgM抗体(Ab)を加えると血中のLPS(抗原)と複合体を形成し、その結果補体の古典的経路の活性化が起こる。形成された(LPS・Ab)C3b
複合体が白血球の補体受容体(CRやCR3)に結合すると白血球が活性化され、活性酸素が産生されるのでルミノール反応で検出する。オプソン化ザイモサン
も共存させて白血球活性化を亢進させている。高濃度LPSを加えた試験管の値を100%、試薬対照を0%として検体のEAA%を検出する。
この方法は複数の段階を含むので、それぞれで影響を受ける可能性がある。特にLPS結合蛋白等のLPSとIgMの結合に対する影響、補体の活性化段階には
抗補体活性を持つ薬剤の影響、白血球の接着分子発現状態、白血球の活性等が懸念される。
結局EAAは、エンドトキシン量とその他の炎症反応に関与する要素(エンドトキシン結合タンパク量、補体活性、接着分子発現量、白血球の活性、活性酸素産生能などを総合的に評価する方法といえる。
著者はこの方法を”間接的”エンドトキシン測定法(indirect endotoxin assay)と呼びたい。もちろん”直接的”エンドトキシン測定法はリムルステストである。
Romschinの原著によると、20 pg/ml以上のエンドトキシンで良好な検量線が得られている。
FDAはこの方法を敗血症の診断法として認可し、EUでも使用が許可されたという。EAAはSIRSで高値を示すことが報告されており、エンドトキシン血症は炎症反応を惹起している広範囲の病態で陽性を示すと考えられている (
Marshal DC. Endotoxin in the pathogenesis of sepsis. Contrib Nephrol 167:1-13,2010)。
最近著者らは市販のEAAキットを検証し、健常者血液に既知のLPSを1 pgから10 ng/mlまで加え比濁時間分析法とで検量線を比較したところ、比濁時間分析法では明瞭な検量線が得られたのに対して、EAAでは1
ng/ml以上でLPS非添加対照に比較して有意に高値を示した。従って市販のキットは原著と異なるものであると云わざるを得ない。また、健常者血液にIL-8やTNF-αを加えて加温したところEAAが高値を示した。このキットでは血中のエンドトキシンが測定されるのではなく、大量のLPSやサイトカインなどでプライミングされた好中球の活性をみていることが推測される(Matsumoto N, Takahashi G, Kojika M, Suzuki Y, Inoue Y, Inada K, Endo
S. Interleukin-8 induces an elevation in the endotoxin activity assay (EAA) level: does the EAA truly measure the endotoxin level?J Infect Chemother 19:825-32,2013)。
→リムルステスト(2)にも詳述
11.抗生物質によるエンドトキシンリリース
ある種のβ-ラクタム系抗生物質は菌の分裂の際に必要な細胞隔壁の合成を抑制する。そのため菌は分裂できず大きなフィラメント状の形態を呈した後に溶菌する。すると一度に多量のエンドトキシンが遊離する(エンドトキシンリリース)。抗生物質を加えない対照群ではどんどん増殖する。培養のある時点で0.2μmの膜で培養液を濾過すると、対照群では菌が死んで遊離したエンドトキシンは非常に少なく(一部自然に死滅するため少しは遊離する)膜を通過するエンドトキシンは少ないが、抗生物質群では遊離したエンドトキシンは非常に多量である。これを生体内で考えると、一度に大量のエンドトキシンが遊離されてエンドトキシンショックを起こすことがあると危惧される。菌のエンドトキシンを加味するとエンドトキシン全量は両群で同じ量といえる(周辺にまき散らされるか否かである)。
今度は実際の生体内で考えてみよう。感染巣の周囲には白血球が集積して(一部はバーストして、脱顆粒して)活性酸素、抗菌物質、エンドトキシン中和蛋白などが殺菌やエンドトキシンを中和しようと待ち構えているであろうことは想像に難くない。ここにエントキシンリリースを起こす抗生物質が加わると、ある時期周囲にエンドトキシンが急速にまき散らかされるが、すでにそこではエンドトキシンは力を発揮できる状態にないことが考えられる。すなわち抗生物質によるエンドトキシンリリースは生体内では特に感染症ではエンドトキシンを中和ないし不活化する環境が備わるため、当該抗生物質への変更によってエンドトキシンショックを起こすような状況はあまり起こらないと考えられる。
12.Bacterial translocationの真実
Bacterial translocationとは正常の消化管粘膜から生菌が腸間膜リンパ節あるいは門脈,さらにそれ以遠へ移行すること.エンドトキシンなど菌体成分の 一部や真菌の侵入など,microbial translocationと呼称される概念も含めて広義に解釈される(日本外科代謝栄養学会用語集から)。
血中エンドトキシンをこの指標とすることが行われている。このホームページで繰り返し書いているように、非特異的方法でエンドトキシンを測定すると種々の病態で高値を示すことがある。これをBacterial
translocationとしてしてしまうのは問題である。別項で詳しく述べた。
→Bacterial translocation
13.喘息とエンドトキシンの関係はある?
Geredaら(Lancet 355:1680-3,2000)はドイツでの農村部に幼少期を過ごした子と都市部の子で比較研究し、農村部の子に喘息発症が低かった。室内のほこりを吸い取ってエンドトキシンをリムルステストで測定し、喘息の少ない農村部の子ではエンドトキシンによる暴露が多いとして、喘息発症の抑制と環境エンドトキシン量に相関があるとした。NHKスペシャルでも取り上げられた(病の起源 第6集 アレルギー ~2億年目の免疫異変http://www.nhk.or.jp/special/detail/2008/1123/)。当時NHKディレクター氏に意見を求められたので、真菌やカビの持つグルカンをも測定する方法での結果を一方的にエンドトキシンに起因させるのは問題であり、日本のエンドトキシン特異的測定法でやれば結果はわからないと話したが私の意見は取り上げられなかった。
3歳児の住環境のエンドトキシン(リムルステスト)やペニシリウム属やアスペルギルス属細胞外多糖を測定し、これらが暴露が後の喘息発症を阻止するとのオランダのコホート研究がある(Douw es J et al, J Allergy Clinic Immunol 117: 1067-73, 2006)。ここで用いられたリムルステストもグルカンにも反応する方法である。
喘息発症予防と環境エンドトキシンの関係を研究するのであればエンドトキシンに特異的なリムルステストを用いてもらいたいものだ。
最近の横断研究の報告では、環境の多くの微生物を分析し、多様な環境微生物に暴露されている小児ほど喘息になりにくいという。特にカビの一種ユーロチウムや、グラム陽性の(エンドトキシンを有しない)リステリア属やバシラス属などの細菌の暴露と喘息が逆相関したと報告されている(Ege
MJ et al, N Engl J Med 364:701-9, 2011)。これらの研究結果にはうなずけるものがある。
Egeらの成績はアレルギー発症の衛生仮説(斎藤博久:衛生仮説,呼吸 25:373-7,2006の総説が詳しい)、すなわち生後多くの微生物に暴露されると、T細胞のTh1/Th2バランスがTh1側に傾き、IgE産生が抑制されるという説と矛盾しない。

|
|
Copyright (C) Katsuya INADA 1997-2012, All rights reserved.
このサイトを利用することにより発生する損害等については一切責任を負わない
|
|