| 5 温泉の化学 5-7 硫黄泉と硫酸塩泉 硫黄泉は独特の匂いや乳白色の濁り湯で人気が高いのにくらべて、おおむね無色無臭でつかみどころのない硫酸塩泉はどうも不人気です。(筆者は隠れ硫酸塩泉ファンですが・・・)。硫黄泉をつくるのは「硫化水素」、硫酸塩泉をつくるのは「硫酸イオン」で、どちらにも「硫」の字が入っていますから、硫黄(S)を含む成分だということは容易に想像できます。同じ硫黄の成分なのにどうして2つに分かれているのでしょう? また、温泉のできかたには何か大きな違いがあるのでしょうか? イオウの化学種はとても多様で40種以上も知られていますが、温泉に関係するおもな9種は酸化数の違いとして以下のように分けられます。硫黄泉をつくる「硫化水素」は酸化数のいちばんマイナス側、硫酸塩泉をつくる「硫酸イオン」は最もプラス側にあります。 酸化数 : 化合物・イオン(*は温泉分析の項目には含まれない)
ひとことでいうと原子のなかの電荷の過不足です。イオウ原子核のまわりには通常で16個の電子(マイナス電荷)がまわっていて、最外殻には6個の電子が含まれます。ところがこの電子の数はあんまり安定な状態ではないので、周囲の環境(酸化還元状態)によって出たり入ったりします。電子(e-)が1個加わるとマイナス電荷が1増えて原子全体の電荷は(-1)になります。反対に電子が1個出ていくとマイナス電荷が1減って原子全体では(+1)になります。 同じ酸化数でのイオウ化学種の変化は以下のようになります。これは水素との結びつき具合が変わるだけなので、pHに依存しています。酸性では式の左辺が出やすく、アルカリ性では右辺が出やすいことになります。下図にはpHが変わるときにそれぞれの量比(mol比)がどのようになるか示してします。 酸化数(-2)のとき 硫化水素系列 H2S HS- + H+
S2- + H+ ・・・(1) |
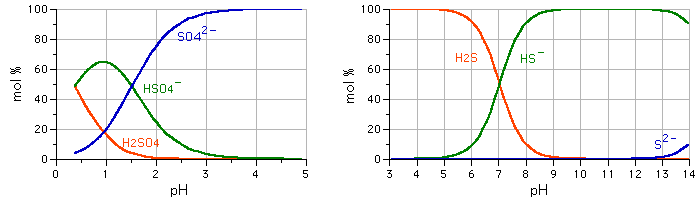
図5-7-1-1 pHが変わるときの各成分の量比 左:硫酸系列 右:硫化水素系列
|
それでは異なる酸化数のあいだの関係はどうなるでしょう。酸化数(-2)の硫化水素系列と、酸化数(+6)の硫酸系列は次のような反応になります。電子(e-)の出入りを伴ってくることが(1)(2)との大きな違いですので、水溶液の酸化還元電位によって状態が変わってきます。酸化環境であるほど反応は右に進みます。 さて、これまでのような関係を一枚の図にまとめると下のようになります。横軸にはpH、縦軸には酸化還元電位(Eh)をとってあります(Ehの説明は次)。各成分の境界ライン(青線)は、それぞれの濃度(mol濃度)が等しくなるところです。ラインをまたぐといきなり全部がぱっと変わってしまうわけではありません。 硫化水素系列の存在できる範囲は意外に狭く、反対に硫酸イオンの存在範囲がとても広いことがわかります。また、図中には単体イオウ(S)が固体として共存できる範囲も示していますが、硫化水素が酸化をうけて硫酸イオンに変わる途中で出てくることがわかります。実際には硫化水素と硫酸イオンの間には、酸化数の異なるさまざまな物質が中間的にできてくるので、これが硫黄泉の多様な色や匂いのバリエーションに関係してくるのかもしれません。 |
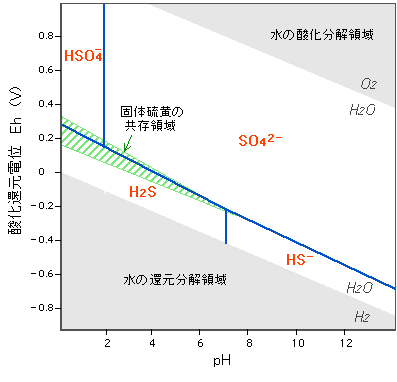
図5-7-1-2 イオウ化学種のpH-Eh安定関係
|
<酸化還元電位とは?> いきなり耳慣れない用語が出てきて恐縮なので、酸化還元についてちょっと説明しておきましょう。 古典的な化学では、物質が酸素と結びつくことを酸化(oxidation)といい、反対に酸素が奪われることを還元(reduction)と解釈していました。たとえば金属マグネシウムが空気中で燃焼すること(A)は典型的な酸化の反応で、酸化銅が水素ガスに触れて金属銅になること(B)は典型的な還元の反応とされました。どちらも理科の実験でおなじみですね。 2・Mg + O2 → 2・MgO ・・・(A) 我々の生活環境では酸素がたくさんあるので、こういう解釈でも実用的にはまったく問題ないのですが、幅広い環境条件を扱うようになるとこれではいささか不都合になります。そこで現代の化学では、物質が電子を失うことを酸化、電子が獲得することを還元というようになりました。上の(A)式の反応では、左辺の金属マグネシウムは単体なので酸化数は(0)ですが、右辺では酸素と結ばれたので酸化数は(+2)になり電子を2個ぶんだけ失っています。その電子はどこにいったかというと、結ばれた酸素原子が単体(0)から酸化数(-2)のO2-になることに使われたのです。酸素の側から見ると電子を獲得したことになるので、(A)式は酸素の還元反応といいかえることもできます。 さて、水溶液に含まれる物質のあいだで酸化還元反応がおこるときには、水じたいも電子のやりとりに加わって次のような状態変化を起こしていきます。(C)は甚だしい酸化環境のとき水分子か電子を失って気体酸素が遊離する反応(酸化分解)で、(D)は甚だしい還元環境のとき水素イオンが電子を獲得して水素ガスが遊離する反応(還元分解)です。 2・H2O → O2 + 4・H+ + 4・e- ・・・・(C) どちらの状態になっても水はもはや液体として存在できませんから、我々の周囲にある水は(C)(D)の中間のどこかにあります。 <温泉水の酸化還元電位> 温泉水が通常の水とかなり異なる酸化還元状態にあることはなんとなく予想されていましたが、実際の測定例は少なく、実態はよくわかりませんでした。最近になって温泉の療養効果と関係があるかもしれないという観点からの研究が行われるようになり、大河内(2002)などの論文にまとめられています。下図ではその論文の挿入図から源泉湧出直後と貯湯直後の値をリライトしてのせてみました(青点)。赤線は大気下の通常水(水道や飲料水)のラインで、温泉は通常水よりも還元性を示すものが多いことがよくわかります。なかには極端に還元性の値を示すものがあり、上の図と比較してみると、こういう温泉水には硫化水素が存在できて硫黄泉になっているものと思われます。 大河内の本論では温泉水の老化(エージング)について言及しており、源泉を放置した後のEh測定値は通常水とほとんど同じになってしまうことが明らかです。このような状態だと硫化水素は存在できないので、単体硫黄(湯の花)として析出沈殿してしまうか、硫酸イオンに変わってしまうものと考えられます。多くても数10mg/kgくらいの硫化水素がまるごと硫酸イオンに変わってしまえば、それは普通の水とたいした違いはなくなってしまいますね。 |
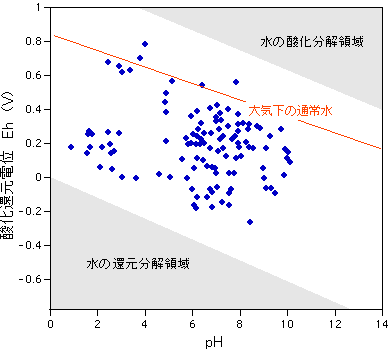
|
(蛇足) |