| 5 温泉の化学 5-6 アルカリ性泉 アルカリ性単純温泉が多いわけ 前項で、高アルカリ性になると塩類泉の割合が減少し単純温泉が主体になっていく、と書きましたが、このところをもう少し詳しくみていきましょう。下図(5-6-2-1)では、274カ所のアルカリ性泉(おもに東日本)の、pHと溶存成分計の相関を示しています。pH値が高くなるにつれて溶存成分が少なくなっていく様子が明瞭にあらわれています。 溶存成分の多い高濃度溶液は、pHの変化を抑制する性質があることが知られており「緩衝溶液」といわれます。たとえば塩化カリウム(KCl)、炭酸水素ナトリウム(NaHCO3)は化学実験室でもよく使われる代表的な緩衝溶液です。これらは多少の酸・塩基の添加があってもpHの変動がほとんどありません。これを参考にすると、温泉をアルカリ性にする外部の要因があっても、溶存成分が濃いときにはなかなか高アルカリ性にまでpHが変化せず、逆に溶存成分が希薄だと、高アルカリ性に容易になりやすいということが考えられます。 前項の分布図の説明で、アルカリ性泉は火山周辺や厚い堆積層のところではつくられないと書きました。火山の近傍では超高温で温泉が形成されるので水−岩石の反応も激しくおこり、溶存成分の豊富な温泉ができやすくなります。厚い堆積層に含まれる温泉は、長時間に岩石と接触していることでこちらも溶存成分は多くなります。アルカリ性単純温泉の大部分は、深層に浸透した地下水が岩石の成分をたくさん溶かし込まないていどの比較的短時間でつくられるものと考えることができます。 じつは、pH10をこえる高アルカリ性泉は世界的にもかなり珍しく、日本特産といってもいいほどです。地温勾配が低い「冷えた」岩盤の多い大陸地域では、深層地下水が留まっている時間が非常に長いため、岩石との反応がじゅうぶんに進んだ高濃度の弱アルカリ性重曹泉が多くみられます(5-5-4章)。日本は地温勾配が高く「温かい」岩盤が多いため深層地下水の対流が活発で、成分が希薄なまま湧出してくる割合が高くなっているものと考えられます。 図5-6-2 pHと溶存成分量の相関 |
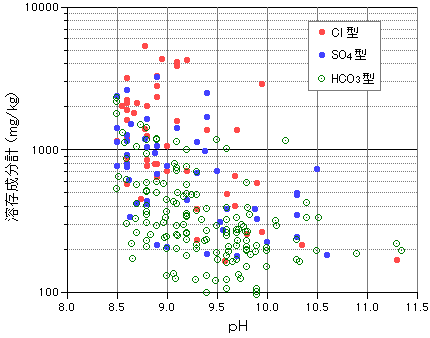
図5-6-2 pHと溶存成分量の相関
|
なぜアルカリ性になる? 水と岩石が反応してアルカリ性になる原因は、じつはあまりよく解明されていません。反応系が非常に複雑なため理論的な検討が難しいのと、長時間(人間的な感覚で)の現象なために実験的な観察が困難なためです。この面倒な課題にとりくんだ研究例にみられる説は、大別すると以下の4点です。かなり難しくなるので詳しくは紹介できませんが、どれが決定的というわけではなく、相互にからみあってくるというのが本当のところでしょう。 1) 岩石(花崗岩)に含まれていた水溶性の炭酸塩(NaCO3など)が溶け出してくる:真木ほか(1994) 道後温泉のボーリングで採取した岩石試料(花崗岩)について、粉末にして水を浸透させ成分の変化をみる「浸出実験」を行い、実際にpH10弱のアルカリ性水が浸出直後につくられることを見出しました。Caや珪酸などの鉱物溶解成分が水中に増えはじめるのは、もう少し時間が経過してからのことなので、鉱物自体が溶けてアルカリ性物質ができるというよりは、鉱物粒子の隙間にたまっていた物質がすばやく溶けてきたと解釈し、これを水溶性の炭酸塩(NaCO3など)ではないかとしています。 2) 岩石鉱物の風化で出来る粘土鉱物に水中の水素イオンが吸収される:一國ほか(1982) どちらも岩石の風化や変質でふつうに見られる粘土鉱物やゼオライトの関与で、アルカリ性になる可能性を理論的に考察したものです。これらの鉱物は水中の陽イオンを固定する性質をもっていますが、水と岩石が長期間に反応して二次的な鉱物ができるときに水素イオンを選択的に吸収すると考えています。 4) 鉱物破断面の負電荷に水素イオンが固定される 最新の説です。岩石の鉱物の骨格(結晶構造)は、ケイ酸(Si)と酸素(O)が絡みあった<−Si−O−Si−>という立体構造になっていて、全体として電気的に中性になっています。ところが、何かの拍子に鉱物が壊れて破断面ができると、<−Si−O->という負電荷の酸素原子が表面に露出してきます。ここに水が接触すると、水素イオンやほかの陽イオンが引きつけられるようになります(電気二重層という)。その割合はひじょうに微々たるものですが、たくさんの破断面を少量の水がすばやく通過していくときには、最終的にOH-の比率が増してアルカリ性に偏るものとみられます。 |