|
高濃度の炭酸水素塩泉ができる成因は、次のような4つが考えられています。1)と2)については前章でも触れましたから、省略します。
1) 火山ガスの吹き込み 2) 地中微生物の活動 3) 石灰岩・炭酸塩鉱物の溶解 4) 岩石とのイオン交換
石灰岩・炭酸塩鉱物の溶解 <重炭酸土類泉ができる>
石灰岩は炭酸カルシウム(CaCO3)を主成分とする岩石で、もとは遠く南の海洋にできたサンゴ礁がプレート運動にのってはるばる日本付近まで運ばれてきたものだとされています。セメントや化学工業の原料として採掘され、日本で自給できる数少ない地下資源です。関東でも葛生・武甲山・奥多摩などに大規模な石灰岩の地層があります。石灰岩とまではいかないでも、ふつうの地層にも炭酸カルシウム(方解石)や炭酸マグネシウム(苦灰石)といった炭酸塩鉱物が多く含まれています。もとは貝やプランクトン(石灰藻)であったものですね。
さて、炭酸塩はふつうの水にはほとんど溶けませんが、炭酸ガスを含む水にはけっこうよく溶けます。これは鍾乳洞ができるメカニズムとして広く知られています。つまり、表層で大気とじゅうぶんに接触した水には、空気中の炭酸ガスの0.4%くらいが含まれるようになり、弱酸性のpH=5.7くらいになっています。これが地下に浸透していくと、地下水の流路に沿った部分の炭酸塩鉱物を溶かしていきます。このときの反応は、
CaCO3 + CO2 + H2O → Ca2+ + 2・HCO3- ・・・・・ (4)
というふうになり、つまりは重炭酸土類泉(Ca-HCO3)ができることになります。炭酸ガスの起源が大気ではなく、火山ガスだったりすると炭酸ガス濃度はずっと濃く、酸性度も上がりますから、さらによく溶けるようになります。また、地下の岩盤中には過去の温泉活動で沈殿した炭酸塩鉱物が断層の亀裂を充填していたりしますから、ここを通路として再び炭酸ガスを含む温泉が通ってきたりしても、高濃度の重炭酸土類泉をつくるようになると考えられます。炭酸塩にはカルシウムの他にマグネシウム(Mg)や鉄(Fe)も含まれていることが普通ですから、こうしてできる温泉はけっこう複雑な成分構成になっていたりします。
岩石とのイオン交換 <炭酸ガスはなくても重曹泉ができる>
炭酸水素塩泉のなかでは、Ca型の重炭酸土類泉よりも、Na型の重曹泉のほうが圧倒的に多くなっています。近年の深いボーリングでどんどん開発される深層地下水型のアルカリ性単純温泉も、イオン型はNa-HCO3になっているのがほとんどです。温泉全体からみても重曹泉型の泉質の比率はとても高くなっており、もはや温泉の主役を食塩泉から奪いつつあります。では、こんなに全国あちこちに重曹泉ができているのは如何なる理由なのでしょう?
炭酸カルシウム鉱物の溶解で重炭酸土類泉(Ca-HCO3)ができるなら、炭酸ナトリウム鉱物の溶解で重曹泉(Na-HCO3)ができるんじゃないかと予想できますね。ところが、岩石中に炭酸ナトリウム鉱物が含まれることはきわめて希で、もし日本で発見されたら鉱物学会がひっくり返るような騒ぎになること間違いありません。この考えはすっぱりあきらめましょう。(註:大陸乾燥地域ではこのようにしてできる強アルカリ性の温泉があるそうです)
高濃度の重曹泉ができるメカニズムは、岩石と地下水との巧妙な反応関係で成り立っています。ちょっとわかりにくいですが、とても面白いので繰り返し読んで理解してください。
<第1段階>
まず、地下水に炭酸カルシウム(CaCO3)が岩石から溶け出します。これは前記の3)と同じです。ただし、炭酸カルシウムの溶解度はとても小さいので、すぐにこれ以上は溶けられないという飽和状態になってしまいます。これだけなら希薄なCa-HCO3型の地下水ができて終わりで、いわゆる普通の地下水です。
CaCO3 + H2O → Ca2+ + HCO3- + OH- ・・・(5)
<第2段階>
岩石中にゼオライト(沸石)や粘土鉱物が含まれている場合、これに地下水が接触すると「陽イオン交換」をおこします。地下水中のカルシウムイオン(Ca2+)と、鉱物中のナトリウムイオン(Na+)が入れ替わるわけです。この反応はひじょうに迅速に数秒単位で起こります。ゼオライトや粘土鉱物は、岩盤をつくる硬い岩石にはあまり含まれていませんが、断層で岩石がすりつぶされてできた断層粘土や、高温の温泉が岩石を侵してできた変質帯にはたくさん含まれています。ここで、地下水は希薄なNa-HCO3型に変化します。同時に、原因はまだ解明されていませんが、pHもアルカリ性になっていくようです。アルカリ性単純温泉はこの段階でおしまいです。
Ca2+ + Na-鉱物 → Na+ + Ca-鉱物 ・・・・(6)
岩石/地下水比が大きいほど反応の割合が大きくなる
<第3段階>
イオン交換で地下水成分からカルシウムが除かれるので、それを補うかたちで岩石から再び炭酸カルシウムが新たに溶けだしてくることが出来るようになります。NaHCO3の溶解度は炭酸カルシウムとはけた違いに大きいので、(5)と(6)の反応が同時に組み合わさると、大量の炭酸水素イオン(HCO32-)が一方的に増えていくことができるわけです。
注目すべきは、上のどの段階にも炭酸ガスの関与はまったく不要なことで、火山のない地域でも地下水と適当な岩石さえあれば、重曹泉が作られるということです。ただし、地下水が岩石中に停滞しているような状況だとすぐに平衡に達してしまうので、ある程度の濃度までで反応はストップしてしまいます。(5)と(6)の反応が繰り返して連続して高濃度の成分になるには、地下水(温泉)が岩盤中を長い距離移動し、常に新しい岩石と接触するような条件が揃わなくてはなりません。地下水の流速はきわめてゆっくりとしたものなので、これには非常に長い時間が必要です。
温泉の「熟成」と表現してもよいかもしれません。
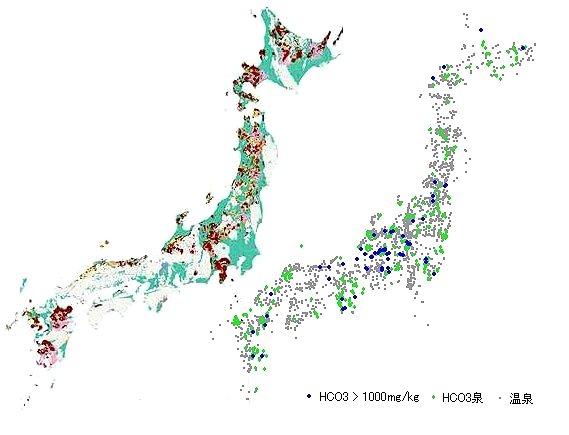
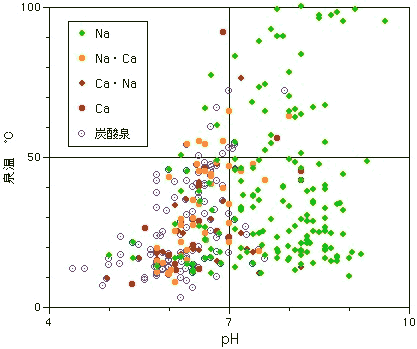
最後に、下の図をちょっと眺めてみてください。これは、炭酸水素イオンを1000mg/kg以上含む温泉の、泉温とpHの関係を陽イオン構成で分けてみたものです。同時に炭酸泉もプロットしてあります。Caを含む重炭酸土類泉タイプと、Naだけの重曹泉タイプとでは分布域に明らかな違いがあることが見てとれます。
重炭酸土類泉タイプの温泉は比較的低温で酸性域にあって、炭酸泉の分布とぴったり重なっています。上記の3)の成因説が裏付けられているものと言えるかと思います。重曹泉タイプは泉温もpHも分布が広く、炭酸泉の分布とはあまり関係がみられないことで、上記4)の成因説を支持しているように思えます。
|