水素イオン指数。水素イオンの濃度をあらわす指数です。
水中の水素イオン濃度をmol/Lの単位で表すと、値が小さく ○×10-○というような値になってピンときません。それでは不便だということで、1909年Sorensenが負の対数で表すことを提案しました。 pHと水素イオン濃度[H+] (mol/L)との関係は
pH=-log[H+]
pHが1下がると水素イオン濃度は10倍になります。
参考:モルってなーに?
全硬度あるいは総硬度といいます。水の中に溶けているカルシウム、マグネシウムの総量を表します。カルシウムに由来する硬度をCa硬度、マグネシウムに由来する硬度をMg硬度といい、これらを合計したものが総硬度です。
単位 はdH (ドイツ硬度) あるいはppm(アメリカ硬度)で表します。 硬度1dHの水1リットル中にはカルシウムイオンとマグネシウムイオンあわせて0.000178モルが含まれています。
Ca硬度
単位 は総硬度と同じくdH (ドイツ硬度) あるいはppm(アメリカ硬度)で表します。
1 dHは水1リットル中に10mgの酸化カルシウム(CaO)が溶解したことに相当するカルシウムイオンがあることを意味します。
アメリカ硬度は水中の炭酸カルシウム(CaCO3)の濃度としてあらわします。
ドイツ硬度とアメリカ硬度の関係は
1dH=17.8ppm
であらわされます。
Mg硬度
単位はカルシウム硬度と同じです。 1 dHは水1リットル中に7.1mgの酸化マグネシウム(MgO)があることを意味します。
全硬度、Ca硬度、Mg硬度の測定法
測定原理:Caイオン、MgイオンはEBT試薬(エリオクロムブラックT指示薬)というものと反応 して赤紫色を示します。EBT試薬はCaやMgイオンが無いときは青色の物質です。CaイオンやMgイオンはEBT試薬よりもEDTA(エチレンジアミン 四酢酸)試薬というものと強く反応します。
最初にEBTを少量加えて赤色に着色しておき、EDTAを加えてやるとCa,MgはEDTAと反応してEBTは裸にされ、反応液は青色に変化します。 この操作で全硬度が測定できます。
Ca硬度
測定しようとする水にアルカリ(水酸化カリウムなど)を加え、pH12-13程度の強いアルカリ性にして数分間放置するとMgイオンは水酸化マグネシウム として沈殿します。この溶液を全硬度と同じように測定すればCa硬度のみを測定することが出来ます。このときはpHが高いのでEBT指示薬ではなく、NN 指示薬(2-オキシ-1-(2-オキシ-4-スルホ-1-ナフチルアゾ-3-ナフトエ酸)というものを使います。
Mg硬度
上記のようにして求めた全硬度とCa硬度から
Mg硬度=全硬度−Ca硬度
として求めます。
GHを測定してみよう
用意するもの:EDTA(エチレンジアミン四酢酸二ナトリウム)、エリオクロムブラックT指示薬、pHを10にするための緩衝液(NH4Cl-NH3溶液)、蒸留水(イオン交換水)、滴ビン、フラスコ、メスシリンダー
EDTA0.01M溶液の調整:
1)エチレンジアミン四酢酸二ナトリウム3.8gを天秤で秤りとります。
2)これに純水(イオン交換水)を加えて1Lにします。
3)密封して保管しましょう。何度でも使えます。
緩衝液の調整
1)塩化アンモニウム6.75gをアンモニア水57mLに溶かし、水を加えて100mLとします。
2)密封して保管しましょう。何度でも使えます。
1滴の容量の測定:
使用する滴ビンに水をいれて、メスシリンダーに水滴を落とし、何滴で1mLになるか測りましょう。およそ20滴で1mLになると思います。この場合1滴は1/20=0.05mLです。測定が終わったら、EDTA溶液を詰めましょう。
測定
試験水10mLをフラスコにとり、pH10の緩衝液数滴とEBT指示薬1滴を加えます。試験水は赤色になります。これにEDTAを滴下し、液が青色になるまで何滴落としたかでGHが測定できます。
計算:変色に要した滴数をa、一滴の容量をbmLとしますと
GH=a*b*100(ppm)=a*b*5.6(dH)
b=0.05として、
GH=5a(ppm)=0.28a(dH)
となります。 EDTA1滴が1dHとなると解りやすいですから、 EDTA試薬の濃度を0.0357Mとする(13.5gのEDTAを溶かして1Lの液にする)のも良いでしょう。
炭酸塩硬度といいます。全硬度はCa硬度とMg硬度の和です。これは硬度を陽イオンで2つに分ける考え方です。CaイオンやMgイオンは対イオンとして陰 イオンを持っているわけで、その陰イオンは炭酸水素イオン(HCO3-)であったり、硫酸イオン(SO4--)であったりします。対イオンとしてHCO3 -を持ったCa、Mg分を炭酸塩硬度(KH)といい、それ以外の対イオン(硫酸イオン、塩素イオンなど)を持ったCa、Mg分を非炭酸塩硬度といいます。
GH=炭酸塩硬度+非炭酸塩硬度であってGH<KHとなることはありません。
炭酸水素カルシウムは煮沸すると
の反応で沈殿してしまうため炭酸塩硬度は一時硬度ともいわれます。
KHを下げたければ水を煮沸すればよいと言うことになりましょうか?
うちでは煮沸してもKHは下がりませんでした
単位 はdH (German degree Hardness) で表します。
1 dHは28.9 mg/L (0.178mmol/L)のCa(HCO3)2(分子量162)に対応します。
測定原理:KHの測定は重炭酸イオンの中和滴定で求めるやり方が一般的です。 HCO3-に酸を加えて滴定し、pHを4まで下げるのに必要な酸の量で測定します。
この方法で測定した値はHCO3-イオンの濃度を示しており、炭酸塩硬度ではありません。水にはNaHCO3なども含まれていますので、GH<KHという、理屈ではありえない値が得られたりします。
明確に区別するため、この方法で求めるKHをアルカリ度という事にしましょう。
アルカリ度を測定してみよう
用意するもの:ブロモクレゾールグリーン指示薬(BCG試薬)、塩酸、滴ビン、フラスコ、メスシリンダー
0.01N塩酸の調整:薬局等で市販の濃塩酸は35%濃度(比重1.19)です。濃すぎるので純水で薄めます。
まず濃塩酸8.3mL(9.88g)をとり、純水を加えて100mLに薄めて下さい。これで1Nの塩酸が出来上がります。1N塩酸10mLに純水を加えて 100mLにすると0.1N塩酸、0.1N塩酸10mLに純水を加えて100mLにすると目的の0.01N塩酸が出来上がります。滴ビンに入れて使用しま す。密栓して保管しましょう。
測定:試験水を10mL採取します。これにBCG指示薬を1滴入れます。
試験水は青く着色します。0.01N塩酸を滴ビンを使って添加し、試験水の色が黄色く変色するまで何滴要したか測定します。(BCG指示薬は塩酸に混ぜておいてもかまいません)
計算:変色に要した滴数をa、一滴の容量をbmLとしますと
KH=a*b*50(ppm)=a*b*2.8(dH)
b=0.05として、
KH=2.5a(ppm)=0.14a(dH)
となります。
試験水の量を7mLとし、0.1N塩酸を測定に使用すると1滴が1dHに相当します。
アルカリ度と重炭酸イオン濃度の関係は
[HCO3-]=アルカリ度×0.178×2×10-3(mol/L)
であらわされます。
参考:KH試薬
炭酸ガスCO2は水に溶解して次のようにイオンになります。
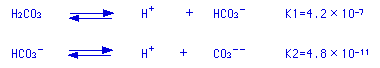
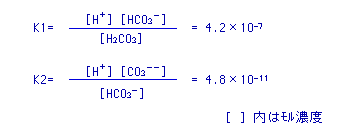
これを利用すると炭酸ガス濃度は
CO2=10(-pH)×KH×0.178×2×10-3÷K1×44 (g/L)となります。
これをまとめますと
CO2(mg/L)=KH×10(-pH)×3.72×107
テトラ社試薬のカタログでpH,KHからCO2濃度を換算する表がありますが、この式で計算した値は表値とは若干異なったものとなります。3.72を3程度にするとあうようです(^^;。CO2濃度計算機はこちら。
読んで字の如く、電気の流れやすさです。電気伝導度、電導率などともいいます。
水に電解質が溶けていると電気が流れます。導電率の高い水ほどイオン(電解質)を多く含んでいるということになります。イオンが多いということを水が汚れ ていると考えれば、導電率は水の汚れの指標とも言えます。藻類は無機イオンを養分として成長するので、導電率の高い水では藻類が蔓延りやすいと言えます が、水草も藻類同様に無機イオンを必要としますので、必ずしも低いことがいいこととは言えません。 参考:導電率の定義
塩素:塩素(Cl2)は常温で気体の有毒な物質です。
水に溶けて
の反応で塩酸や次亜塩素酸を生じ、酸性を示します。
水道水には必ず塩素(ClO-, 次亜塩素酸イオン)が含まれています。1957年に成立した水道法によって水道水に塩素の添加が義務付けられています。 この法律で、蛇口から出る水から遊離塩素として0.1ppm(結合残留塩素とした場合0.4ppm)以上保持するように添加することが 決まっています(遊離塩素とは次亜塩素酸イオン、結合塩素とはアンモニアと結合したクロラミンというNH2Cl,NHCl2,NCl3等の化合物のことで す)。
法律では下限値しか定めておりませんので、あなたの家の水道水にどれくらいの塩素が添加されているかはわかりませんが、約1ppmといったところでしょうか。
遊離塩素は強い酸化力を持っていて、魚や細菌を殺してしまいます。
塩素の除去にはハイポ(チオ硫酸ナトリウム5水塩、Na2S2O3・5H2O)を加えるか、活性炭処理が有効です。
ハイポ処理に必要な量は極めて微量です。塩素とハイポの反応は
Na2S2O3 + 4Cl0- + H2O → 2NaCl + 2SO4-- + 2HCl
です。水道水中の塩素が1ppmとして、0.9ppmのハイポを加えれば中和出来ます。100Lの水に90mg入れれば良いわけです。1回の換水に1粒で十分です。
ハイポを必要以上に加えるのは良くないという話も聞きますが、それ程厳密に考えることはないと思います。
(ハイポの添加は不必要な無機イオン濃度を増やすことになりますので、私は滅多に使いません。活性炭処理を行っています。)
窒素サイクル
水槽内には魚の糞、残餌、死骸、枯葉などの分解によって窒素化合物が生成、蓄積します。窒素の存在形態としては
1)各種有機窒素化合物
2)アンモニウムイオン(NH4+)・アンモニア(NH3)
3)亜硝酸イオン(NO2-)
4)硝酸イオン(NO3-)
5)窒素(N2ガス)等があります。
窒素化合物のうち、アンモニアや亜硝酸は魚に対する毒性があるので、バクテリアによって酸化してもらい、硝酸イオンにする必要があります。これが濾過の目的であるのはご存じだと思います。
NH4+ → NO2- → NO3- の変化を酸化といい、逆の反応を還元といいます。
水槽内でまず発生するのが有機態窒素、これが分解されてアンモニア性窒素となり、バクテリア(Nitrosomonas)により亜硝酸イオンに酸化され、硝化細菌( Nitrobacter)によって硝酸イオンに酸化されます。 これらの細菌は自分の細胞を構成する炭素源として二酸化炭素(CO2)を使っています。植物はCO2を炭水化物に変える際に光エネルギーを利用していますが、これらの細菌は光の代わりに窒素化合物の酸化エネルギーを利用して生きています。
硝酸イオンとなった窒素はどうなるでしょうか?これらを利用している生物がいます。
大 腸菌や枯草菌は硝酸イオンをアンモニアに還元します。また、Pseudomonas denitrificans, Denitrobacillusなどの細菌は硝酸をアンモニアにではなく、窒素ガスに還元します。これらの細菌にかかると、窒素は完全に無害な窒素ガスと して大気中に戻るわけです。これを脱窒といいます。
最近、還元バクテリアによる還元濾過が広まっていますが、これらを使えば硝酸を窒素に変えて無害化が可能であり、窒素サイクルをアクアリウムで完成するこ とが可能なように思われます。しかし、これらの細菌には有毒なアンモニアを作るものもいる訳でありまして、これを利用するには酸化濾過をしっかりと行うこ とが大前提と考えます。
脱窒とは逆に、大気中の窒素をアンモニアや硝酸にすることを窒素固定といいます。 人間は化学肥料の原料として、窒素ガスと水素ガスを高温高圧で反応させてアンモニアを大量に作っていますが、これも窒素固定です。
生物の中には常温常圧で窒素を固定する者がいます。好気性土壌細菌(Azotobactor), 嫌気性土壌細菌(Clostridium属),光合成細菌(Rhodospririllum rubrum), 藍藻類(Myxophyceae)等の非共生細菌、マメ科植物に寄生する根粒菌(Rhizobia)等がそれです。これらはアンモニアを利用して自分自身 の組織(蛋白質など)を作りますが、窒素が余ると土壌に放出します。藍藻はNH3、アミノ酸等を排出します。このためきつい臭いを放ちますが、この窒素が 空気から出来たと知れば藍藻の見方も少しは変わるでしょうか?
植物に必要な窒素を補給する手段として、自然界で有用な生物達ではありますが、窒素が豊富にあるアクアリウムではこれらの生物は歓迎されません。
硝酸イオンの適量は?
酸素を豊富に含む綺麗な水の中では窒素は主として硝酸イオンの形で存在しています。窒素というのは植物にとってはリン酸やカリウムとともに、3大栄養素といわれ、絶対必要なものであります。
しかし、多ければいいという物でもありません。水道水の水質基準では硝酸、亜硝酸窒素の合計は10ppm以下と定められています。このような値が定められているということは、これ以上の窒素を含んだ水は人間にさえ危ないという意味もあるように思えます。
硝酸イオン濃度はどの程度が適切でしょうか?
天然水の硝酸イオン濃度は雨水で0.2-0.4ppm、河川上流の綺麗な水で1ppm以下と言われます(雨水が硝酸イオンを含むのは、排気ガスや種々の原 因で発生した窒素酸化物(NOx)を吸収してしまう為です)。我が家の水道水は0.4ppmの硝酸イオンを含んでいました(97年6月8日)。
地蔵川の湧き水に揺れているバイカモを見ますと、植物が10ppmもの硝酸イオンを必要としているとは思えません。
アクアリウム雑誌等の執筆活動をされている宮本久氏に硝酸濃度はどの程度が適切かお聞きしたところ、「1ppmの硝酸塩があれば水草は育つ」とのことでしたので、私はそれ以来、目標を1ppm以下としています。
尚、淡水藻類の増殖に必要な窒素、リン濃度はそれぞれ0.2ppm、0.02ppm程度と言われ10)、植物を育てようとする限り、藻類の増殖を防止することは不可能なように思われます。
水草と魚の量のバランスは重要な問題です。飼育する魚の数を少なくし、かつ水草を密植すれば、水草が硝酸イオンを吸収する速度は魚の排泄物から発生する速度を上まわるでしょう。
水草によって硝酸イオンが吸収され、不足した硝酸イオンを換水によって水道水から補給する。これが理想的な水槽のイメージではないかと思っています。
硝酸の蓄積量を計算してみよう
では具体的に硝酸はどれくらい蓄積してゆくでしょうか?これは給餌量と換水量から比較的簡単に計算できます。まず餌を見て下さい。粗タンパクとか粗脂肪 分、粗繊維、粗灰分などに関する成分表示があるかと思います。硝酸塩は蛋白質中の窒素から生成します。一部は魚や水草に吸収されたり、脱窒されたりすると 思いますがこれは無視して計算してみます。
蛋白質中の窒素分はおよそおよそ10〜20%と考えられます。私の使っている餌はTetraMinの輸入品でMin. Crude Protein45.0% の表示がありますので、その15%が窒素としますと、窒素含量は45*0.15=6.8%、約7%となります。ちなみにリン分 はMin. Phosphorus 1.3%の表示がありますのでリンの蓄積についても合わせて考えてみます。
私のところでは62g入りの餌を約半年かけて消費しますので一日の消費量は62÷6÷30=0.34gとなります。
このうち窒素が7%、リンが1.3%ですから
一日の窒素の添加量:0.34*0.07=0.024g(23.8mg)
一日のリンの添加量:0.34*0.013=0.004g(4.4mg)となります
1週間では7倍の量ですから
一週間の窒素の添加量:167mg
一週間のリンの添加量:31mg
これが全て硝酸とリン酸になるとしますと
一週間の硝酸の生成量:167*62/14=740mg
一週間のリン酸の生成量:31*95/31=95mg
1週間に1/3水換をするとしますとこのうちの1/3は水槽の外に出されますから 蓄積量はこの2/3(493mg)に相当します。次の週はさらに493mgが追加されて、その2/3が残ります。毎週1/3の水換をしたとして濃度の変化をシミュレーションしてみましょう(水道水の硝酸濃度は無視します)。結果を下図に示します。 1/3換水するのですから1週間での硝酸生成量の3倍以上には蓄積しないはずです。
水草の吸収量は無視してよいのか?
との指摘を頂きました(Thanks!>HIDEAKIさん)
これでは、ただの熱帯魚水槽のシミュレーションになってしまいます。
水草の吸収量を考えてみましょう。水草はどれくらい窒素を吸収するのでしょうか?
魚のいない水槽でアクアフローラ(オランダ製水草用肥料)を使用した場合を考えてみます。
この肥料は12粒55g入りで、90cm水槽の適量は10粒(45.8g)そのうちの窒素含量は14%(6.4g)120日効果が持続するそうですので1日あたり6.4/120=0.053g (53mg)が90cm水槽に密に植えた水草の一日の吸収量ということになります。
実際に植物の窒素含量は乾燥重量の1-2%7)ということですので、1週間にトリミングする量を100g、乾燥重量で約5gとしますと注1)、吸収量は0.1g/週、14mg/日という計算になります。
これは、上で計算した餌による添加量24mg/日より差し引くとは蓄積量10mg/日と計算できます。
この値で再度硝酸の蓄積量を計算してみますと濃度は6ppm程度になることがわかりました。 実際には私の水槽の硝酸濃度は10ppmほどあるのですが、これは窒素肥料(アクアフローラ)を入れていることが原因と考えられます。水草水槽では脱窒などしなくてもバランスがとれる可能性は十分にあると考えられます。
注1)98/10/10(土)のトリミング時に測定したところ、(G.アンブリア、ヘテランテラ、ロタラマクランドラ、アマニアグラキリス、ミズトラノオ)カット分85g、一晩放置して乾燥したところ、約4g程度まで減少しました。
硝酸濃度の測定方法
亜硝酸、硝酸、アンモニア等の測定については操作が複雑ですが、比較的簡単に測定できる試薬がアクアリウム用品として販売されています。低濃度の測定が出来ない商品もありますので、購入の際は十分ご注意下さい。
水の汚染の指標としてCOD(化学的酸素消費量)という目安があります。水中の有機物を化学的に酸化分解するために必要な酸素の量を示します。アクアリウ ムではあまり問題にしませんが、水中の有機物量の指標として、河川水等では重要な数値です。測定は過マンガン酸カリウムという劇物を使用しますので、省略 しますが、簡単な試験試薬が売られています。測定してみたい方は
共立理化学研究所
〒145 東京都大田区田園調布5-37-11
tel:03-721-9207
まで、お問い合わせ下さい。
ヤマメやイワナはCODが1mg/L以下でないと住めないと言われています。詳しくは 琵琶湖の水質の知識のページをご覧下さい。
水道水は
1)基準項目 健康に関する項目(29項目)
2)水道水が有すべき性状に関する項目(17項目)
3)快適水質項目(13項目)
4)監視項目(26項目)
の4つの項目にわけて管理されています。詳細な測定項目は東京都の水道ページでご覧になれます。
(大阪市水道局の測定値は大阪市水道局)をご覧下さい
水道水がどのように処理されて出来るかは、こちらでご覧になれます。
水道局のホームページですので安全性が強調されていますが、日本の水質基準は欧米に比較すると基準が甘く、危険性があるといわれています。
水道水中の塩素は人間の動脈硬化(心臓発作)の原因となるとも言われています。また、アトピー性皮膚炎の原因とも言われています。飲料水について深く考えるには、下記の文献5, 8, 9の他、図書館には多くの本がありますので、是非ご一読下さい。