◆リムルステストの開発
米国東海岸にあるマサチューセッツ州ウッズホールの海洋研究所で、カブトガニの 血流について研究をしていたFrederick Bangはビブリオによる感染症で死んだカブトガニの血液が凝固していることを見つけた。さらにカブトガニ グラム陰性菌の死菌を注射しても血液が固まる(ゲル化)ことを明らかにした。彼は1956年にこの成果を発表し、グラム陰性菌外膜成分のエンドトキシンに よるシュヴァルツマン反応等とよく似た現象であることを記載した(Bang FB, Bull Johns Hopkins Hosp 98: 325-51,1956)。
Bangは、ジョンスホプキンス大学に移ってからも血液学者のJack Levinと共同で研究を続け、エンドトキシンによって血球抽出液(lysate、 ライセート)がゲル化することを発見した(Levin J and Bang FB, Bull Johns Hopkins Hosp 115: 265-74,1964)。
その後多くの研究によって、エンドトキシンによるカブトガニ血液のゲル化反応は、エンドトキシンが血液中の唯一の細胞(アメーボサイト、 Tachypleusでは2種ある)を破裂(爆発)させ、細胞内の凝固系を活性化する結果であることがわかった。
そして1968年にこの現象を利用したエンドトキシンの定量法;リムルステストが開発された。
リムルステストの実用化には二つの大きな目的があった。一つは医療器具や生物製剤(生物材料を起源とする医薬品)のパイロジェン(発熱素、エンドトキシン が主なもの)試験をウサギ発熱試験の代替法として使用することであり、米国FDAは1983年に認可した。日本では第11改正日本薬局方追補(1988 年)で注射用水への適用が収載され、その後多くの医薬品へ適用されるようになった。
今一つの目的はエンドトキシンの血中濃度測定である。このホームページでは主にこのことを中心に述べる。
エンドトキシンは『生物活性』の項にあるように非常な多彩な生物活性を有しており、腸管常在菌のうちの大勢を占めるグラム陰性菌のエンドトキシンが種々の 病態に関与していることが古くから推察されていた。血中エンドトキシンを簡単に測定する方法が求められていたが、リムルステストはその要求に合うものであった。
ヒトの病態での血中エンドトキシンの定量にこの方法を応用したのは玉熊正悦も加わったFineらのグループが最初のようでである(Rojas-Corona RR, Skarnes R, Tamakuma S, Fine, J Proc Soc Exp Biol Med.132:599-601, 1969)。
リムルステストで血液(血漿や血清)中エンドトキシンを定量する際、血漿中の凝固因子や阻害因子が反応に影響することがわかり、クロロホルム法、希釈加熱法などの前処理法が開発された。
1970年代にはいるとリムルステストは、エンドトキシンの病態における役割を明らかにするため盛んに使われるようになった。
日本で最初に発売されたリムルス試薬は帝国臓器のプレゲルで、1973年のことである。プレゲルはライセートを凍結乾燥してアンプルに封じており、著者も血漿をクロロフォルム処理や水希釈加熱処理を行ってから測定したものである。
◆特異的定量法の開発
プレゲルではng/mlレベルのエンドトキシンの定性的検出ができるようになったが、ゲル化を目視判定するので、陽性と陰性の境界を判定するのは容易ではなかった。
奥口は著者との研究でスライドグラス上でに反応を行いブロムフェノールブルーなどの色素でCoagulinを染色し判定を容易にする方法を考案した(Okuguchi S, Microbiol Immunol 22:113-121, 1978)。
定量的な方法の試みとして、ゲルをSDSで可溶化して濁度を測定する方法や、丹羽允らのクロット蛋白定量法などが考案された。
血液凝固の研究者である岩永貞昭らはライセー中の凝固に関与する因子であるクロッティング酵素やその基質であるコアギュローゲンを明らかにした。この知見 に基づき最初の定量法として発色合成基質法が開発され(Iwanaga S, Morita T et al. Haemostasis 7:183, 1978)、トキシカラ-テスト(生化学工業;当時)として発売された。この方法はゲル化法に比較して定量性や検出感度が高まった。
1981年、KakinumaらやMoritaらは別々に、β-(1→3)-D-グルカンがライセートを凝固させるとの衝撃的な報告を行ない、リムルステ ストの新しい歴史が開かれた(Kakinuma A, et al, Biochem Biophys Res Commun 101;434,1981、Morita et al, FEBS Lett, 129, 318, 1981 )。
岩永らのグループはT. tridentatusやL.polyphemusの血球amebocyteのライセート中にエンドトキシンに反応するC因子系とグルカンに反応するG因子系が存在することを明らかにし、関与する因子をすべて解明した(Morita T, Tanaka S, et al, FEBS let 129, 318- 321,1981など)
そして1985年には画期的な事として、エンドトキシンに特異的発色合成基質法が開発された(Obayashi T et al, Clin Chim Acta. 149:55,1985、エンドスペシー:生化学工業)。
エンドスペシーは、血漿の前処理法としての過塩素酸処理法(Obayashi et al, J Lab Clin Med 104:321,1984)とセットで血漿中エンドトキシンの特異的測定法として販売された。この方法は健康保険適用された最初の方法である。
続いて和光純薬工業は1985年にトキシノメーターを用いる比濁時間分析法を開発し、1991年にはエンドトキシンに特異的な比濁時間分析法を世に出した。
そして、β-D-グルカンに特異的な発色合成基質や比濁時間分析法も開発され、深在性真菌症の早期診断法として高い評価を得ることになる。
◆C因子について
LPSと結合するC因子は分子量約15万のセリンプロテアーゼ前駆体で、LPSと特異的に結合すると活性化される。Dingらは酵母を用いてC因子の組換え体を作成し、エンドトキシンに特異的な方法を考案した。C因子にはLPSと結合できる二つの部位(sushiドメイン)があるが、ミ セルを形成しているLPSにはC因子結合部位(リピドA)が多数あることになるので、両者は大きな複合体を形成できる(Pui AWM, Ho B, Ding JL. J Endotoxin Res 4, 391-400,1997)。
最近リコンビナントC因子が開発され、エンドトキシンの定量に用いられるようになった。
| 図1 カブトガニ血球抽出液でおこるエンドトキシンとグルカンによるゲル化反応 | |
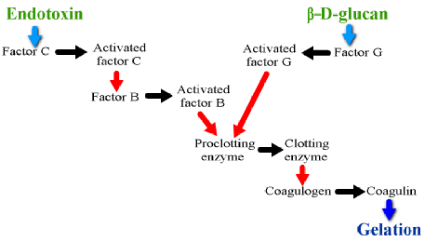 |
岩永らによって解明されたリムルスカスケード反応の機構。これをもとにその後エンドトキシンやグルカンの測定法が開発された。 |
◆リムルステストの種類
表に日本で用いられているあるいは入手可能な主なリムルステストを示した。
リムルステストに用いる血球抽出液(ライセート)は、カブトガニの種類の違いでLAL(Limulus amebocyte lysate)またはTAL(Tachypleus amebocyte lysate)と呼ぶ。単にALとすることもある。
エンドトキシンに特異的な定量試薬としてはエンドスペシー(生化学工業、発色合成基質法)と、エンドトキシンシングルテストワコー(和光純薬工業、比濁時 間分析法)がある。前者はTALをデキストラン硫酸セファロースカラムで分画後、FactorG画分を除いて再構成したものである(現在はLALを用いて いる)。後者は、LALにカルボキシメチル化カードラン(β-D-グルカン)を大過剰添加し、G因子系の活性化を逆に抑制させてエンドトキシン特異的にし たキットである。組み換え体C因子を用いたエンドトキシン特異法もある。
グルカンに特異的な試薬としてはファンギテック(発色合成基質法、生化学工業)、β-グルカンテストワコー(比濁時間分析法、和光純薬工業)やマルハ社 (発色合成基質法)のものがある。活性化C因子に対するモノクローナル抗体をライセートに加えるてグルカン特異的にすることもできる(参考9)。発色合成基質法や比濁時間分析法に応用できる簡便な方法である。
リムルステストはウサギ発熱試験に代わりて医薬品の製造過程におけるエンドトキシン量のモニタリングに必要不可欠な方法として使用されるようになった(エンドトキシン試験法、エンドトキシン特異的方法には限定していない)。以下の表は著者の知りうるリムルステストを示した。
| 表 日本で入手可能な主なリムルステスト(2014年1月更新) | |||
|---|---|---|---|
| 測定原理 | 非特異的 | エンドトキシン特異的 | グルカン特異的 |
| ゲル化法 (定性、半定量) |
パイロテルT(生化学)、リムルスJテストワコーなど(和光)、パイロジェント(ロンザ) | リムルスES-IIテストなど(和光) | |
| 発色合成基質法 (図2) |
トキシカラー(生化学)パイロクロム(生化学)QCL-1000(ロンザ)、Kinetic-QCL(ロンザ) | エンドスペシー(生化学)、リムルスカラーKYテストワコー(和光) | ファンギテックGテストMK(生化学工業、2012年から日水製薬に移行;ファンギテックGテストMKII「ニッスイ」)、β-グルカンテストマルハ(マルハ)、*Fungitell(生化学、FDA認可) |
| 比濁法、 比濁時間分析法(図3) |
パイロテルT(生化学)、HS-テストワコー(和光)、パイロジェント5000(ロンザ) | リムルスES-IIテストなど(和光)、リムルスカラーKY(和光)、エンドトキシンシングルテストワコー(和光)、Pyrostar(和光、FDA製造承認) | βーグルカンテストワコー(和光) |
| リコンビナントC因子を用いる方法 (蛍光法) |
PyroGene(ロンザ、図4)、EndoLISA(HyGlos)、EndoZyme(HyGlos) | ||
| その他 | 簡易型エンドトキシン測定システムEndosafe-PTS(チャールス・リバー、和光、図5) | リムルスPSシングルテストワコー(和光、図6) | |
アンダーラインしたものは日本の体外診断薬
これらにはFDA認可品、FDA対応品、日本薬局方認可品、エンドポイント法、カイネティック法、試験管法、マイクロプレート法などがある。また、ゲル化法以外はそれぞれに特化した機器・ソフトを必要とする。測定感度はそれぞれで異なる。各社Webサイトを参照されたい。著者の知り得る限り、比濁時間分析法エンドトキシンシングルテストワコーの検出感度が最も低く0.004前後である。
・生化学;生化学工業株式会社
・和光;和光純薬工業株式会社
・マルハ;株式会社マルハニチロホールディングス
・ロンザ;ロンザジャパン株式会社
・HyGlos(デンマーク)(日本代理店;JKI)
*Fungitellは生化学工業の子会社Associates of Cape Code製
◆特異的にする方法
エンドトキシン特異的にする:エンドスペシー(和光純薬工業)はクロマトグラフィーでG因子を除去してある。エンドトキシンテストワコー(和光純薬工業)ではグルカンを大量加えてG因子が働かないようにしてある。ロンザ社やCharles Riverはエンドトキシンに特異的にする添加剤(おそらくグルカン)をそれぞれB-G-ブロッカー、Endotoxin-specific bufferという商品名で販売しており、これをリムルス試薬に加えるとエンドトキシンに特異的なる。
グルカン特異的にする:グルカンテストワコーでは血漿検体を予め希釈加熱処理する際にポリミキシンBを共存させエンドトキシンにによるC因子の活性化を抑制している。ポリミキシンBは土壌微生物由来の抗生物質でLPSと特異的に結合するため、LPS活性の阻害剤として良く用いられる(但しポリミキシン耐性のLPSがあるとの報告もあることに留意する)。ポリミキシンBはエンドトキシンの多くの生物活性をLPS重量の数倍から100倍濃度で抑制す るが、リムルス活性を抑制するためにはLPS重量の10万倍以上必要である。C因子はLPSと非常に強固に結合することを示している。
グルスペシー (生化学工業、保険適用診断薬名:ファンギテックGテスト)や(ビージースター(マルハ)はそれぞれ異なる方法(クロマトグラフィー)エンド トキシンに反応するC因子を除外してある。
ま た、特殊免疫研究所と我々の作製した活性化C因子に対するモノクローナル抗体(特殊免疫研究所で販売)はライセートに加えるとグルカン特異的になる。
| 図2 発色合成基質法 | |
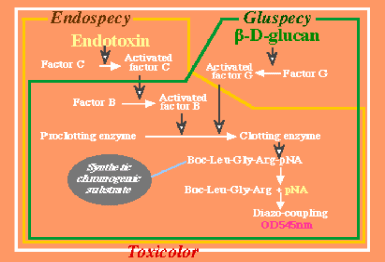 |
Clotting enzymeの基質として発色合成基質を用いる。例えばエンドスペシー(生化学工業)では基質としてBoc-Leu-Glu-Arg-pNAを用い、遊離したしたpNA(パラニトロアニリン)
量をOD505nmで分光測光するか、さらにpNAをジアゾカップリングして、生成したアゾ色素量を545nmで分光測光する(エンドポイント法)。pNA量の増加を405nmでモニターし、1分あたりの増加率を算出する方法などによるカイネティック法などが最近は一般的である。β-グルカンテストマルハでは、これとは異なる発色合成基質(Boc-Thr-Gly-Arg-11D)を用い、遊離した
N-エチル-N-β-ヒドロキシエチル-p-アミノアニリン(11D)を、発色液の添加によりN,N-ジエチルアニリンを酸化縮合しその酸化縮合生成物を730nmで比色定量する。
|
| 図3 比濁時間分析法 | |
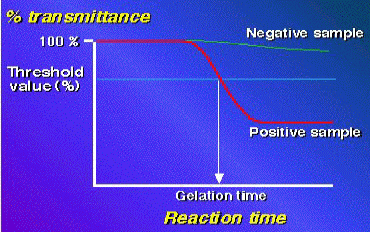 |
測定には専用機器トキシノメーターをいる。ゲル化により生じる濁度変化を透過光量比(%transmittance)として捉え、反応開始100%から一定の閾値(threshold
value%)に達する時間をゲル化時間(gelation time)とする。 エンドトキシン濃度とゲル化時間とは両対数プロットでほぼ直線に近い関係を示す。 |
| 図4 ロンザ社の蛍光法 | |
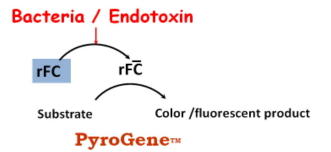 |
DingらはCarcinoscorpius rotundicaudaのC因子のcDNAをクローニングし、酵母(Pichia pastoris)に発現させた(Ding J L et al, J Endotoxin Res 4:33-43,1997)。PyroGeneはこの組み換え体C因子を用いた測定法である。エンドトキシンによって活性化された組み換え体C因子が、蛍光基質を分解し蛍光を発生させる。 |
| 図5 簡易型エンドトキシン測定システムEndosafe-PTS(チャールス・リバー、和光) | |
 |
使い捨てカートリッジの微小な流路に試料をポンプで流して、途中の凍結乾燥してあるLALおよび発色合成基質と出会うと反応して呈色するシステムである。登録されている検量線によってエンドトキシンを定量する。特異性はない。FDA認可品である(和光純薬工業から発売)。 |
| 図6 リムルスPSシングルテストワコー | |
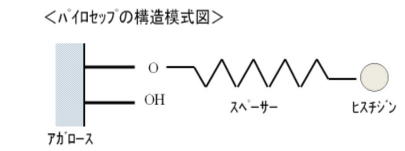 |
アガロースにスペーサーを介してヒスチジンを結合させたアフィニティ吸着体(パイロセップ;左図)、エンドトキシンを特異的に吸着させる特徴がある。 洗浄後リムルス試薬を加えて吸着したエンドトキシン量を測定する。 エンドトキシンはエタノール中でもパイロセップ゚に吸着するため、通常のリムルステストでは不可能な脂溶性試料(油脂類、脂溶性ビタミン、リン脂質、オイ ルアジュバントのワクチンなど)でもエタノールに溶解できればエンドトキシンンの測定が可能である。 本間らはパイロセップ法でアルブミン製剤、凝固因子製剤(第8因子)、インターフェロン製剤、アンチスロンビンⅢ製剤、免疫グロブリン製剤のエンドトキシ ンを測定したところ、従来の水希釈法に比較して効率よくエンドトキシンを検出できたと報告している(日本血液学会発表、1994年5月)。 |
◆レーザー散乱光粒子測定法
エンドトキシンを高感度に測定できるといわれる血漿中エンドトキシン測定に応用す るべく検討されている。リムルステスト(2)で詳述する。
◆発光合成基質測定法
通常の10倍以上の発光強度を有 するルシフェラーゼを用いる方法である。。測定系の安定性と簡易性が保証されれば血液エンドトキシン定量法として使用できよう。リムルステスト(2)で詳述する。
◆ペプタイドドア社の取り組み
ペプタイドドア社はターゲット(タンパク質、脂質等)に親和性を持つペプチドを探す技術としてのPhage Display法を応用し、エンドトキシンとの 結合力の強いペプチドLi5-025を作成し、通常のLAL法では困難な試料に応用し、エンドトキシンを吸着させて測定する手法を開発した(Pep-Abser Pre- treatment for LAL)。さらに、試料中のエンドトキシンの除去カラムPep-Abser LPS removal columnも考案した。今後が期待される。
解離定数を比較すると(測定法が異なる文献的比較なので、正確ではないが)ペプチドLi5-025は従来のポリミキシンBや、LBP、抗LPSIgM抗体などに比較してエンドトキシンとより強い結合を起こすと考えられる。
最近、この手法での測定サービスも行う様になった。最近、Li5-025及びその誘導体を用いたエンドトキシン検出、エンドトキシン除去及び回収製品の全世界での開発・販売権(研究・診断分野)をチャールス・リバー・ラボラトリーズに付与した。
◆グルカンのリムルス活性
βグルカンは真菌や植 物などが保有する細胞壁成分多糖で、β配位したグルコピラノースを構成糖とする。結合様式からβ-1,4-結合したグルカンであるセルロースのほか、キノ コや真菌の成分であるβ-1,3-グルカン、β-1,3-グルカン主鎖にβ-1,6-グルカン鎖が分枝しているものなどがある。
リムルス活性を示すのはおもにβ-1,3-グルカンである。β-1,6-グルカン鎖の分枝の数がリムルス活性を修飾(阻害)して いる事も考えられている。グルカンは特徴的な螺旋構造をとるが、なかでも最も安定な三重螺旋構造ではリムルス活性が弱く、NaOH、DMSO、尿素などで 処理することによりランダムコイルや一重鎖構造を取るようになると活性が上昇する。キノコのグルカン量を測定するときは予め1N NaOHで処理すると活性 が上昇することがわかっている。深在性真菌症の診断で血漿中のグルカン量を測定する際に血漿のリムルス影響因子除去法であるアルカリ処理法(生化学工業) が血漿中の影響因子の除去のみならずグルカン活性を上昇している可能性も考えられる。
さらにグルコースの重合度がリムルス活性に影響する。田中らによると種々の重合度のβ-1,3-グルカンがG因子を活性化させる能力は重合度(数平均モル重量から概算)36で全くなく、重合度42、60、90、175、1333で反応した。高濃度グルカンでは反応阻害が見られることは柿沼等が報告してお り、被検標品のグルカン量を定量するときは、一濃度のみでなく希釈して測定すると定量できることがある。
G因子はβ-1,3,D-グルカン(植物多糖で、真菌細胞壁の構成成分)で活性化される。G因子系は深在性真菌血症で陽性を示す。また、抗腫瘍多糖を靜注さ れている患者血漿で強い陽性を示す(経口投与血漿では陽性にならない)。さらに、セルロース系の膜で透析治療をうけている患者血漿でも強い陽性を示す(セルロースはβ-1,4-結合グルカンでありリムルス活性はないがおそらく夾雑するβ-1,3-グルカンの溶出による)。また原因は不明であるが肝不全、消化器 病術後、人工心肺術後、羊水などでもその強弱はあれ陽性を示す。生体内由来のG因子系の活性化物質の存在が考えられているがその本体は不明である。このよ う理由から臨床検体のエンドトキシン量を正確に測定するためにはエンドトキシン特異的な測定キットの使用が必須である。
◆他のエンドトキシン測定法
エンドトキシンすなわちLPSを化学的に定量することは非常に難しい。LPSにのみ存在する水酸化脂肪酸を目安にクロマトグラフィーで分析することは可能である。しかし、菌種によって炭素数の異なる脂肪酸でLPS は構成されている点に留意する必要がある。髄膜炎菌髄膜炎患者の血中エンドトキシン量がリムルステストで1 ng/ml以上の場合に(通常敗血症患者の血中濃度は数pから数十pg/mlである)、この菌のLPSを構成する水酸化したラウリン酸(C12脂肪酸)をガスクロやガスマスで解析できたという報告がある(Brandtzaeg P et al. J Clin Invest 89:816-823,1992)。
ウサギ発熱試験は古くからエンドトキシンを代表とする発熱素(パイロジェン)の検査法として用いられてきた(エンドトキシンの生物活性の発熱性の項参照)。しかし、ウサギの体温が約1℃上昇する量はウサギ1kg当たり5ngである。現在日本薬局方では医薬品の製造工程でのモニタリングや最終品についてはリムルステストで検定し規格量として5EU/Kg/hrとしている。その他の方法としてニワトリ胚致死試験もあった。
多くのLPSに共通のコア多糖を含むリピッドA 部分(内部コア、エンドトキシンとは?の図2参照)に対する抗体を用いてELISA法を構築できるが簡便性、犬種感度は比濁時間分析法に及ばない。
エンドトキシンに感受性のある培養細胞を用いてサイトカイン等の産生を見る方法も開発されている。その感度は10 pg/ml程度である(Yamamoto A et al, Jpn J Infect Dis 56:93-100, 2003)。
水晶振動子を用いるバイオセンシングシステムを応用したエンドトキシン定量法がある。発振子表面でのゲル化による発信周波数の変位を捉える方法や、ポリミキシンBを発振子に結合させエンドトキシンとの特異的結合による変化を捉える手法も提唱されている。
◆新しい方法;電気化学的検出法
アンペロメトリー(電圧を一定にしたときの電流量を測定する))やボルタンメトリー(電圧を変化させてそのときの電流量の変動を測定する)などの電気化学的手法でエンドトキシンを検出する方法が最近考案されている。以下に例を挙げる。
①スクリーン状にプリントした電極表面での電気化学種フェリシアン化カリによる通電量がゲル化反応により阻害されるのをアンペロメトリーで検出する(Miao K et al, Electrochem Commun 26:29-32,2013) 。
②発色合成基質Boc-Leu-Glu-Arg-pNAからpNAが遊離することによる電気信号の変化を微分パルスボルタンメトリーで検出する(Inoue KY et al, Innate Immunol 18:343-9,2012)。
③新規の合成基質Boc-Leu-Glu-Arg-p-aminophenolからのp-aminophenolの遊離による電気的変化をアンペロメトリーで検出する方法(Inoue KY et al, Analyst1 38:6523-31,2013)。
④エンドトキシンによる組換え体C因子の活性化による基質Boc-Val -Prou-Arg-pNAから遊離するpNAを微分パルスボルタンメトリーで検出する方法(Inoue KY et al, Electrochem Commun 12:1066-69,2010)。
⑤アプタマーを用いる方法:低分子物質や蛋白等のターゲットと特異的に結合する特定の塩基配列をもつDNAやRNAをアプタマーと呼び、ターゲットの活性を阻害する効果が期待される。抗原抗体反応に匹敵するあるいはそれ以上のアフィニティーをもつ反応系として注目されている。アタプターは一般的にはSELEX法(ターゲットとの結合と解離、PCRによるアダプターの増幅を繰り返して大量を得る方法)で選択される。Kimらはこれとは異なる方法ではあるがエンドトキシンに対する1本鎖DNAアプタマーを得て、その結合を電気信号検出器で検出するエンドトキシン定量を考案した(Kim SE et al, Anal Biochem 424:12-20,2012)。
⑥金電極表面にカブトガニ由来エンドトキシン中和蛋白(ENP)をCMデキストランを介して結合させ、ここに一定量のビオチン化LPS と測定すべきLPS を加えて競合的な電極への結合をおこさせる。洗浄後ニュートラビジン結合HRPをビオチン化LPSに結合させ、ここに過酸化水素とレドックスメディエーターを加え、生じる電流信号を捉える。LPS量と電流信号は逆相関する(Priano et al. Anal Biochem 362:108-16, 2007)。ニュートラビジンは糖質を含まないアビジンで、非特異的反応を減ずるために用いた。
⑥組換え体TLR4MD-2を結合させた作用電極、銀と塩化銀電極(参照電極)、白金電極(対極)とで構成されたエンドトキシンセンサーを用いて、作用電極にLPSが結合することによりフェリシアンイオンの酸化還元反応による電流量が減少することを微分パルスボルタンメトリーにより計測する方法。検出感度は0.0002 EU/mlという(Yeo TY et al, Biosens Bioelectron 28: 139-45, 2011)。
⑦塩化ビニール・マレイン酸酢酸ビニール重合体をコーティングし、システイン結合金ナノ粒子を介してブラジル産豆科植物レクチンCramoLLを結合させた金電極で、LPS糖鎖とレクチンと結合した結果妨げられる電気化学的変化をインピーダンススペクトル法で検出する方法(Oliveria et al, J Colloid Interface Sci 362,194-201, 2011)。
⑧電極表面でのグルコース酸化酵素によるグルコースの酸化とポリミキシンB結合フェロセンの酸化還元連続反応の系を、エンドトキシンがポリミキシンBとの結合により阻害することによっておこる電解化学的変化を捉える方法(IIjima S et al, Biosens Bioelectron 26:2080-4,2011)。
⑨HEK293細胞にTLR4・MD・2CD14を遺伝子導入で発現させ、LPSとの結合によりレポーターー蛋白である分泌型アルカリフォスファターゼの発現によりp-aminophenyl phosphateから遊離したp-aminophenolをアンペロメトリーで検出する方法:細胞センサー法(Inoue KY et al, Electrochemistry 76:525-528, 2008)。
これらの方法の多くは⑥を除いて、検出限界は1 pgから10 pg程度であり、エントキシン試験法には十分使用可能な感度であり、カブトガニを保護する観点からもこれらの方法は大いに期待される手法といえる。とはいえ、他の物質やイオンの影響、ノイズ除去等実用化における障壁を明らかにし、あればそれを回避する必要がある。また、安定なセンサー電極の作成技術やその保存性、量産性、簡便性も課題として上がられよう。
電気化学的方法は血液中のエンドトキシンの定量への応用も期待されるが、検出感度の他血中の蛋白等影響等を回避する前処理法の開発等が必要になる場合もあろう。
参考文献、リンクはリムルステスト(2)の文末に一括掲載
→リムルステスト(2)