![]()
◆体外診断医薬品としてのエンドトキシン・グルカン測定法
本邦では、現在体外診断医薬品として使用されているリムルステストにはエンドトキシンに特異的なエンドトキシンテストワコーと、グルカン測定法のグルカンテストワコー、ファンギテックテスト、β-グルカンテストマルハである。
米国FDAは2004年、グルカン定量法fungitell(ACC、生化学工業の米国子会社)を深在性真菌症の診断法として認可した。これはその後欧州連合EUでの流通が可能なCEマークも得た。
エンドトキシン測定法についてはPyrostar ES-F(和光純薬工業)が2012年にFDAの製造承認を得たので、米国において医薬品のエンドトキシンモニタリングには使用可能になると考えられるが、診断薬承認まではさらなる時間が必要であろう。著者の知る限り欧米のカンパニーがこれまで特異試薬を開発することはなかった。
これまで欧米のエンドトキシンの臨床的研究は殆どがエンドトキシンに特異的でないリムルステストを用いて行われており、エンドトキシン血症の率が結果的に高く、病態におけるエンドトキシンの役割を過大評価していることに注意しなければならない。
◆血液エンドトキシンの定量と血液の前処理法
血液中のエンドトキシンを定量することは、リムルステストができてからの大きな目的であった。
赤血球は前処理段階で溶血し、ヘモグロビンは比色法でも比濁法でも測定系に影響するので、赤血球は除去する必要があるので、試料としては血清や血漿を用いる。血漿としては多血小板血漿(PRP)や血小板の 少ない血漿(PPP)を用いるが、エンドトキシンは血小板に結合している場合があるのでPRPを用いることが勧められてきた。
血漿中にはリムルステストの阻害因子(α2-plasmin inhibitor、antithrombin III、α1-antitrypsin) や亢進因子(factor Xa、thrombin、trypsin)があるのでこれらを予め除去ないし不活化する必要がある。エンドスペシー法と NewPCA法の組み合わせで検討したところ、ヒト正常血漿中のリムルス阻害活性は血漿を256倍に希釈しても認められ、亢進活性は32倍に希釈しても認められる(文献1)。
以下にこれまで日本で用いられてきた血漿の前処理法を記載する。なかには問題点が指摘されて販売が中止されたものもある。
①過塩素酸処理法(PCA法):エンドスペシーに最初に用いられていた前処理法である。血漿タンパク からLPSのみを得るため除蛋白剤PCAを加えて生じた沈殿(変性蛋白)を除去して遠心上清を測定に供する。しかし、LPSは多くの血漿蛋白と特異的に、非特異的に結合しているため、沈殿として除去されてしまう。アルカリ処理法が開発されるまで使用された。
②New PCA処理法:岩手医科大学医学部細菌学教室で開発された方法で、PCA法では除去されてしまう蛋白結合エンドトキシン(血中では全エンドトキシンの80%以上)も測定可能にした方法。New
PCA法の試薬はキットとしては入手できなかった。こ れを行うときは、PCAと0.18M NaOHはPCA法のキットのものを用い、0.2Mトリス塩酸緩衝液pH8.0(25℃)は市販されているものを用い
た。この方法とエンドスペシー法を用いて著者らは種々の病態における血中エンドトキシン量の測定した。一時代を築いた方法と言っても過言ではない(文献1,2)。
1980年代後半から1990年代の前半は、PCA法とNew PCA法の論争が盛んに行われたが、血漿中のフリ-エンドトキシンのほか蛋白に結合したエンドトキシンをも測定できるNew PCA法に軍配が上がったのは当然と言えよう。血漿中には蛋白と特異的にあるいは非特異的に結合しているエンドトキシンが殆どで、蛋白に結合していないエンドトキシンはわずかしかないと言っていい。
③アルカリ処理法:PCA法に代わる方法として開発された方法である。血漿をTritonX- 100、KOH等を含むアルカリ性溶液で5倍に希釈し、37℃で10分加温する(Tamura H et al, Clin Chim Acta 226:109-12,1994)。血漿へLPSを添加して回収する実験ではPCA法では直ちにリムルス活性は消失する(蛋白とともに除去される)が、アルカリ処理法ではNew PCA法と同等の成績である(大林民典、田村弘志、集中治療 11:119-24,1999)。
しかしアルカリ処理法は非特異的濁りがを生じることがあり、偽陽性反応を示すことが指摘された(文献14)。偽陽性の原因が KOHであることが明らかにされ、KOHの量を減じる修正がされたが、完全には修正できず体外診断薬エンドスペシーは発売が中止された。現在体外診断薬 β-D-グルカン測定試薬ファンギテックGテストMKには改良したアルカリ処理法が用いられ、偽陽性反応は無視できるまで改良されている(吉田耕一 郎、真菌誌 47:135-42,2006)。
④希釈加熱法およびその変法:水で10倍に希釈し、80℃程度で加熱する方法は、欧米では従来から用いられてきた。現在行われている和光純薬工業の比濁時間分析法のキットでは界面活性剤水溶液(0.02%TritonX-100)で10倍に希釈し、70℃、10分加熱する方法が用いられている。
◆エンドトキシン測定に供する臨床検体とその採取法
血漿:ヘパリンで内壁を濡らした注射器で無菌的に採血し、汎用の卓上遠心機で3000 rpm(1200×g)で40秒遠心し、多血小板血漿PRPを得る。この遠心条件は、著者が薦める方法で、この遠心条件は血小板を除去せずに赤血球のみを除去する最低の条件でもあるが、細菌を沈澱させない最低条件でもある。細菌を沈澱
させないほうがエンドトキシン陽性率、即ちグラム陰性菌敗血症の診断率が向上するがことが期待される(細菌でもリムルステスト陽性になるから)。この意味
から血清は用いるべきではない。また、エンドトキシンは蛋白に非特異的に結合することが多いから、出来るだけ蛋白を除去しない方法がいい。その意味でも血
漿の方が血清より優れていると考えられる(文献2,3)。
尿:エンドトキシンやグルカンを測定して、抗生剤投与した複雑性尿路感染症の補助的診断法として有用である。血尿は3000 rpmで40秒遠心し上清を用 いる。水で10倍希釈して測定に供する(文献4)。
髄液:グラム陰性菌髄膜炎の早期診断法として有用である(SLP test for peptidoglycanを 参照)。水で10倍に希釈するか血漿と同様の前処理をする(文献6,7,17)。
![]()
◆高感度エンドトキシン定量法
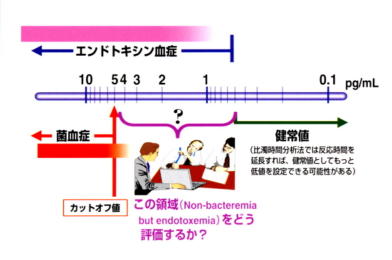
比濁時間分析法では、エンドトキシン血中濃度のカットオフ値は血液培養の成績と比較して得た成績からメーカー側が設定したカットオフ値5pg/mlは、敗
血症患者での特異度は極めて高いものの,感度はかならずしも満足すべきものではなかった(カットオフ値5pg/mlで感度56%、特異度99%)。すなわ
ち、無病正診率は満足するが、有病正診率は極めて悪い。そこで我々は、SIRSの定義でのsepsisでの感度、特異度を設定することにした(下図)。
比濁時間分析法では、反応時間を延長することにより、原理的にはより低濃度のエンドトキシンが測定できる。それまでメーカー側の機器の測定時間は120分
に固定されており、一般的に最低約3.5pg/mlの血中エンドトキシンを測定できた。そこで、メーカー側の協力で、測定時間の機器的設定を解除して測定することとして、症例数健常人66例,sepsis31例,SIRS患者37例で行った結果、カットオフ値1.1pg/mlで感度81.3%l、特異度
86.1%を得ることができた。このSepsis31例は従来の5pg/mlでは11例(35%)が陽性、新カットオフでは25例81%が陽性となる。結局このカットオフ値の測定のため、現在メーカー側はトキシノメーターの測定時間を200分に変更した。安定したロットの提供により、このカットオフ値が多くの検査センターで採用されるに至った(文献18)。
| 図1 高感度定量法の想定図 | |
 |
稲田捷也、TORAYMYXIN UPDATE No. 7(東レ・メディカル、2002) |
◆血中エンドトキシの測定と血液培養の違い
血中にエンドトキシンが検出される場合には次の3つの状況が考えられる。
①Bacteremia and endotoxemia:血液培養陽性とエンドトキシン血症が一致する例でよく理解できる。
②Bacteremia but non-endotoxemia:グラム陰性菌が血中から検出されるのにエンドトキシンが陰性の場合であるる。これまでによく質問を受けた問題である。著者らの検討ではグラム陰性菌1個のエンドトキシン量は菌種にもよるが100
fg(0.1 pg)程度(あるいはそれ以下)であるので,リムルステストでエンドトキシン量10 pg/mlを得るためには100個/mlの菌数が必要になる。血液培養では最初にカルチャーボトルなどで増菌培養を行うから、この程度の菌数でも血液培養陽性になることがあり得る。即ち血液培養はリムルステ
ストよりむしろ高感度な方法といえる。増菌培養で感度を10の8乗倍(一晩の菌数増加)以上も高くされてはかなわない。なお、血液から血漿を得る段階で、
遠心分離で菌が除去されれば結局エンドトキシンが失われるので注意が必要である(上記血漿の採取法参照)。リムルステストの検出感度がさらにたかまれば
Bacteremia but non-endotoxemiaの一部はBacteremia and endotoxemiaになる場合も出てこよう。
③Non-bacteremia but endotoxemia:菌よりもエンドトキシンとして血中に検出され場合である。感染局所からエンドトキシンとして血中に入った場合や、腸管の常在細菌叢由来のエンドトキシンが血中に入った場合が考えられよう。前者の場合は感染症でよく見られると考えられる。後者の場合endotoxin
translocationといえるが頻度は少ないだろうと考える。
エンドトキシンをbacterial translocationの指標にする考え方があるが③の場合もあるから容認できない。まして非特異的リムルステスト陽性をエンドトキシンと考えてbacterial translocationの指標とすることはもってのほかである。
◆グルカン特異的リムルステストを用いた深在性真菌症の診断
前項「リムルステスト/リムルステストによるグルカンの測定」の記述参照されたい。
著者らはグルカン特異的測定法が開発されるまで、血漿を検体として、当時はNewPCA法で前処理後に古典的リムルステストトキシカラーとエンドトキシン特異的測定法エンドスペシーを同時に行いその差を便宜的にグルカン値(カットオフ値を60pg/mlと設定)として深在性真菌症の診断における有用性を明らかにした(遠藤との共著「エンドトキシンの病態」に詳述)。そのなかで、G因子系は深在性真菌血症で陽性を示すのは当然として、抗腫瘍多糖を靜注さ
れている患者血漿で強い陽性を示すこと(経口投与の場合は陽性を示すことはなかった)。さらに、セルロース系の膜で透析治療をうけている患者血漿でも非常に強い陽性を示す。また肝疾患、消化器病の術後、人工心肺術後、羊水などでもその強弱はあれ陽性を示す。
手術に用いるガーゼ由来の可能性もあるが、手術とは無関係な病態もあることから生体内由来のG因子系の活性化物質の存在が考えられているがその本体は不明である。
著者らは当該活性が血管由来の可能性を考えて研究したが物質の同定にまで至らなかった。
新鮮凍結血漿やγグロブリン製剤などの血液由来の製剤中にもグルカンが含まれる場合があるが、調整・精製過程にセルロース系の資材を用いることが原因である可能性がある。
このような著者らの経験から、グルカンあるいはグルカン様活性は色々な病態や治療で検出されるから臨床検体のエンドトキシン量を正確に測定するためにはエンドトキシン特異的な測定キットの使用が必須であることは明確である。
現在本邦では3種の保健適応グルカン測定法が用いられている(吉田耕一郎、真菌誌 47、135-142、2006)
◆なぜ欧米ではリムルステストの分別定量法がこれまで使用されなかった?
リムルステストがグルカンにも反応することを分子論的に明らかにしたのが日本の卓越した血液凝固の研究者岩永貞昭とそのグループであった。彼らは日本産カブトガニTachypleus tridentatusアメーボサイト内 のエンドトキシンとグルカンの両反応系を見事に明らかにしてくれた。Levinら米国の研究者達は米国産カブトガニLimulus polyphemusにはG因子系を見いだせないなどと抵抗したが結局敗北した。米国内にはその屈辱感が現在に至るまで残っておりかたくなにグルカン系を認めない風潮ができあがったのかも知れない。2004年に生化学工業は米国のLAL製造メーカーACCを100%子会社化して日本式のグルカン特異的測定法を米国FDAに認可させた。最近和光純薬工業がエンドトキシン特異的測定法の製造承認をFDAから得た。日本の出来事から四半世紀たっている。
◆新しい血中エンドトキシン測定法(1)レーザー散乱光粒子測定法
小幡徹と興和㈱が開発した方法で、血小板凝集能測定装置を用い、LALとサンプルを1,000 rpm回転させ、caogulin重合による粒子数増加を
レーザー散乱光で捉える。通常のLAL試薬を用いることができる。エンドトキシンを高感度に測定できるといわれている。血漿中エンドトキシン測定に応用するべく検討されている。
最近著者らは水や血漿を100倍希釈した場合には偽陽性反応が発生することを明らかにしヒト血清アルブミンを加える改良法を開発した(稲田捷也他, 日本薬学会第131年会(静岡)光散乱エンドトキシン測定法における偽陽性反応発生の機序と改良、2011年3月)。
| 図2 レーザー散乱光粒子測定法 | |
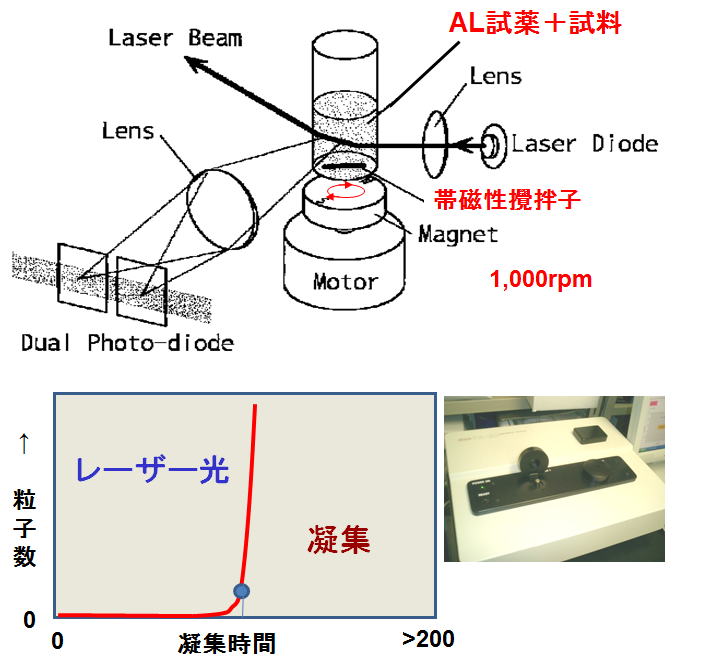 |
直径6 mmの試験管に帯磁性攪拌子が入っており、リムルス試薬と試料を加えて高速回転させて、レーザー光路を横切る粒子を捉える。 |
◆新しい血中エンドトキシン測定法(2)発光合成基質測定法
広島大学大学院先端物質科学研究科分子生命機能科学黒田章夫教授らが開発した方法で、北米産ルシフェラーゼの遺伝子を改変した、10倍以上の発光強度を有 するルシフェラーゼを用いる。測定系の安定性と簡易性が保証されれば血液エンドトキシン定量法として有望である(文献20)。
| 図3 発光合成基質法 | |
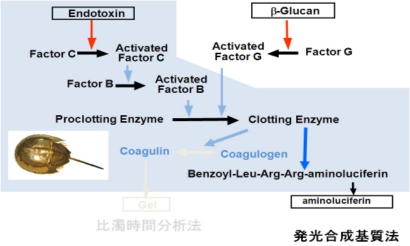 |
Clotting enzymeの基質として発光合成基質(Benzoyl-Leu-Arg-Arg-aminoluciferin)を用い、遊離aminoluciferinがATPと高感度ルシフェラーゼによって発光することをルミノメーターで測定する。 |
◆さらなる展開:白血球エンドトキシン定量法
エンドトキシンは白血球の受容体に結合して白血球を活性化する。血液中のエンドトキシンの存在状態として、血漿中以外に白血球結合状態のものもあると考えられる。さらに細菌を貪食して細胞内にエンドトキシンが存在することも考えられる。そこで、白血球上あるいは白血球内のエンドトキシンを測定する発想が生
まれた。白血球単独、白血球と血漿を含むもの(赤血球を除いて)など試行錯誤しているが、結果的には白血球エンドトキシン測定法では非常に興味ある結果を得ている(文献17)。即ち、sepsisでは血漿エンドトキシンと、白血球エンドトキシンの推移が異なることである。我々はさらに簡易な方法として、ヒドロキシエチル澱粉(HES)を用いて得た多白血球血漿(LRP)を用いる方法を開発した(文献21,22)。
◆EAA(endotoxin activityassay)について(リムルステストではないが)
全血に抗LPSIgM抗体(Ab)を加えると血中LPSと複合体を形成し、その結果補体の古典的経路の活性化が起こる。形成された(LPS・Ab)C3b
複合体が白血球の補体受容体(CRやCR3)に結合すると白血球が活性化され、活性酸素が産生されるのでルミノール反応で検出する。オプソン化ザイモサンも共存させて白血球活性化を亢進させている。高濃度LPSを加えた試験管の値を100%、試薬対照を0%として検体のEAA%を検出する。
この方法は複数の段階を含むので、それぞれで影響を受ける可能性がある。特にLPS結合蛋白等のLPSとIgMの結合に対する影響、補体の活性化段階には
抗補体活性を持つ薬剤の影響、白血球の接着分子発現状態、白血球の活性等が懸念される。
結局EAAは、エンドトキシン量とその他の炎症反応に関与する要素(エンドトキシン結合タンパク量、補体活性、接着分子発現量、白血球の活性、活性酸素産生能などを総合的に評価する方法といえる。
著者はこの方法を”間接的”エンドトキシン測定法(indirect endotoxin assay)と呼びたい。もちろん”直接的”エンドトキシン測定法はリムルステストである。
FDAはこの方法を敗血症の診断法として認可し、EUでも使用が許可されたという.
EAAはSIRSでも高値を示し、エンドトキシン特異的リムルステストとの乖離が問題になっている。
最近Matsumotoら(文献23)は市販のEAAキッとを用いて種々の角度から検証を行い、その問題点を指摘した。
①EAAキッの構成の問題として、Nil試験管には無関係のマウス抗体を加えて、血液検体中のHAMA(human anti-mouse antibody)によるバックグラウンド反応を本反応試験管の値から消去するべきであること(HAMAは多くの検体で検出されることを確認した)。
②検体を採取後2時間以内に測定するよう指定されているが、この時間内でも時間とともにEAA値が大きく上昇する場合(特に敗血症患者で)があり、測定までの時間を一定にしないと検体間の比較は出来ないと考えられること。
③健常者血液にpgからng/mlのLPSを加えて比濁法とEAAでの回収を試みたところ、比濁法ではLPSの量依存性が明瞭に見られたのに対してEAAでは1
ng/mlでやっと対照値(LPS非添加)を有意に超えた。EAAの開発者のRomaschinの論文(Romaschin AD et al, J
Immunol Method 212:169-85,1998)では20 pg/mlがEAA値が検出限界と報告されているがその違いはどのように説明できるのか?。
④健常者血液のEAA測定に於いてIL-8を加えると、EAA 値が量依存性に上昇した。TNF-αでも同様の効果があった。
以上のように市販のEAAキットでは通常のエンドトキシン血症の場合のエンドトキシン量1 pg(カットオフ値)から数十pg/mを測定することはできなかった。市販のEAAキットはIL-8やTNF-α、大量のエンドトキシンなど
によってプライミングされた白血球の活性を測定する方法であると考えられる。
著者らの主な文献
1) Inada K, Endo S, et al, Establishment of a new perchloric acid treatment method to allow determination of the total endotoxin content in human plasma by the limulus test and clinical application. Microbiol Immunol 35:303-14,1991
2) 稲田捷也 他:血中エンドトキシンの定量法、日本細菌学会誌 45:937-42,1990
3) 稲田捷也:エンドトキシンの試験法(日本細菌学会編)菜根出版、pp148-164,1990
4) 工藤卓次、稲田捷也、リムルステストを用いたグラム陰性菌および真菌による尿路感染症迅速診断法の有用性、岩手医誌 46:183-93,1994
4) 稲田捷也:エンドトキシン、新しい治療・診断・検査(中野昌康、小玉正智編)講談社サイエンティフィク、pp163-69,1995
5) 遠藤重厚、稲田捷也:エンドトキシンと病態、へるす出版、1995
6) 一戸貞人、稲田捷也 他:エンドトキシンに特異的なリムルステストを用いた髄液中エンドトキシン定量の化膿性髄膜炎における有用性、感染症誌 69:1227-34,
1995
7) Suda H, Moroi C, et al., Application of a new perchloric acid treatment
method to measure endotoxin by an endotoxin-specific chromogenic Limulus
test in neonatal septicemia. Acta Paediat Japon 37: 579-81, 1995
8) 稲田捷也、遠藤重厚:EndotoxemiaとSIRS、救急医学 20:1021-4,1996
9) Yoshida M, Inada K, et al, An assay method of (1, 3)-β-D-glucan to diagnose
invasive mycosis. A utilization of monoclonal antibody to the activated
factor C in blood coagulation system of horseshoe crab. In Fugal
cells in biodefense mechanism (S.Suzuki & M. Suzuki eds), Saikon Publishing
Co., Ltd. (Tokyo), pp265-271,1996
10)稲田捷也:エンドトキシンの測定と問題点、肝胆膵 35:287-93,1997
11) Mori T, Ikemoto H, et al. Clinical evaluation of plasma (1,3)-β-D-glucan measurement by the kinetic turbidimetric Limulus test for the clinical diagnosis of mycotic infections. Eur J Clin Chem Clin Biochem 35:553-60,1997
12)稲田捷也、遠藤重厚:エンドトキシンとサイトカイン、救急医学 22:1613-18,1998
13) 稲田捷也、遠藤重厚:エンドトキシンの疾患における役割、日集中医誌 6:337-45, 1999
14) 稲田捷也、遠藤重厚:リムルス試薬を用いた血中エンドトキシンおよびβ-グルカン定量におけるカイネティック法での特異反応と非特異反応の判別. 医学と薬学 42:885-97,1999
15) 稲田捷也、遠藤重厚:徹底分析シリーズ・エンドトキシン エンドトキシンの定量法 LISA 6:838-44,1999
16) 稲田捷也、久保居真奈美、遠藤重厚、佐藤成大:最近のエンドトキシン測定法の問題点、エンドトキシン血症救命治療研究会誌 5:9-12, 2001
17) Inada K, Takahashi K, Ichinohe S, Suda H, Tsuchiya M, Takahashi J, Matsuura S, Kasai T, Yoshida M, Endo S, Sato S. :A silkworm larvae plasma test for detecting peptidoglycan in cerebrospinal fluid is useful for the diagnosis of bacterial meningitis. Microbiol Immunol 47::701-7, 2003
18) 八重樫泰法、稲田捷也、佐藤信博、小鹿雅博、鈴木泰、遠藤重厚:高感度エンドトキシン測定によるsepsisの診断とPMX療法の評価、エンドトキシン研究7 可能性を求めて、医学図書出版,
175-81, 2004
19) 八重樫泰法、稲田捷也、佐藤信博、小鹿雅博、鈴木泰、遠藤重厚:白血球分画のエンドトキシン測定について、エンドトキシン研究7 可能性を求めて、医学図書出版,
182-8, 2004
20) Onodera C, Takahashi G, Kan S, Shozushima T, Matsumoto N, Inada K, Endo S. Experimental application of a synthetic luminescent substrate assay using endotoxin-specific limulus amebocyte lysate to human blood. J Infect Chemother 18:370-7,2012
21) 菅重典、高橋学、小野寺ちあき、増田卓之、松本尚也、稲田捷也、遠藤重厚.多白血球血漿を用いたエンドトキシン測定法の基礎的研究.臨床病理 60:1045-52,2012
22) Kan S, Takahashi G, Onodera C, Shouzushima T, Matsumoto N, Inada K, Endo S. Evaluation of an endotoxin-specific limulus amebocyte lysate assay using leukocyte-rich plasma for the diagnosis of gram-negative bacterial infection J Infect Chemother 19:299-304,2013
23) Matsumoto N, Takahashi G, Kojika M, Suzuki Y, Inoue Y, Inada K,
Endo S. Interleukin-8 induces an elevation in the endotoxin activity assay (EAA)
level: does the EAA truly measure the endotoxin level? J Infect Chemother 19:825-32,2013
24) 稲田捷也:敗血症研究のためのエンドトキシン定量法の開発と評価、敗血症の診断/治療の実状と病態・メカニズムをふまえた開発戦略、(株)技術情報協会
105-10,2013
リムルステスト リンク
生化学工業株式会社:LAL試薬サイト
和光純薬工業株式会社:このサイトにTalking of LAL(土谷正和博士のエンドトキシンやリムルステストについてのお話)あり
ロンザジャパン株式会社
東レ・メディカルのEAAサイト
Spectral DiagnosticsInc.
大学院先端物質科学研究科分子生命機能科学専攻黒田研究室:発光合成基質測定法を開発した黒田教授の研究室
株式会社ペプチドドア社
![]()
→リムルステスト