化学ⅠB 資料2 物質の構成(化学の基本法則)
2年 組 番 氏名( )
物質を分けていくと、→やがてそれ以上分解できない基本粒子 = ( 原子 )
質量保存の法則 1774 ラボアジェ
「化学反応の前後では、物質の質量は変わらない。」
化学変化のときの質量変化に着目
密閉容器の中なら全体の質量が変わらないことを見つけた。
硫黄やリンが燃えるとき、質量が増加することを天秤を用いて実証した。
例 水素4g と 酸素32g から 水36g
硫黄16g と 酸素32g から 二酸化硫黄48g
定比例の法則 1799 プルースト
「同じ化合物なら、成分元素の質量比はいつも一定になっている。」
炭酸銅の成分を調べ、天然のものも、実験室でつくったものも炭素・酸素・銅の質量の比はいつも一定であることを見出した。
例 18gの水 をつくる 水素は2g : 酸素は16g その質量比=いつも 1 : 8
倍数比例の法則 1803 ドルトン
「同じ2種類の元素を含む別々の化合物A,Bがあるとき、一方の元素の一定量と化合するもう一方の元素の質量をAとBの間で比べると、簡単な整数比になる。」
炭素と酸素が化合した化合物には、一酸化炭素CO と 二酸化炭素CO2がある。
同じ質量の炭素と化合している酸素の質量の比は、CO:CO2=1:2となっている。
例 CO の中の C12g とO16g CO2の中のC12g O32g
Cの一定量12gと化合するそれぞれのOの質量比は 16:32= 1: 2となる。
ドルトンの原子説 1808 ドルトン
気体反応の法則 1808 ゲーリュサック
「温度と圧力が一定なら、反応する気体や生成する気体の体積の間には、簡単な整数比が成り立つ。」
気体どうしが反応するときの体積の関係を調べた。
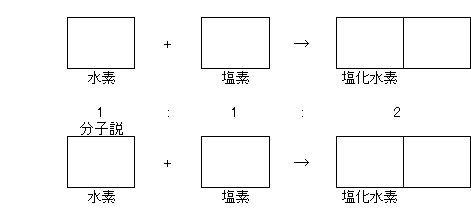
水素+塩素→塩化水素 常に1:1:2の体積比になる
アボガドロの分子説 1811 アボガドロ
ドルトンの原子説
定比例の法則や倍数比例の法則を説明するため
①物質は原子からできていて、原子は分割できない。
②原子には、固有の性質と質量がある。
③化合物は、2種類以上の原子が一定の個数ずつ結合したものである。
化合…→ 原子が結合し合うこと。 分解…→原子の結合が分かれること。
化合物が決まれば、結合している原子の種類と数が決まる。
化学反応のときに、原子は新しくできることも、なくなることもない。
アボガドロの分子説
「気体は、同温・同圧において、同体積中に同数の分子を含む。」
気体反応の法則を説明するため
ドルトンの原子説 ”温度と圧力が一定のとき、同じ体積の気体には同数の原子が含まれる”
次の反応の説明ができない。
水素+塩素→塩化水素 水素原子と塩素原子をそれぞれ2分割するほかない。(原子説の否定)

アボガドロは、水素や塩素の気体は、2個の原子が結合した分子の集まりだと考えた。
物質の表し方 現在は、元素記号を用い、物質をつくっている原子の種類と数を表す。
化学式
・分子式…基本粒子が分子の場合
例 H O2 O3 N CO CO2 NH3 NO2
・組成式…単に成分の組成だけを表す
例 NaCl CaCl2 NaOH Mg(OH)2