化学ⅠB 実験
【実験題目】 中和滴定
【実験日】 年 月 日 曜日 校時
【実験者氏名】 年 組 番 班( )
【協同実験者】( )( )( )( )
【目的】 中和滴定により、市販の食酢中に含まれる酢酸の濃度を調べる。
【準備】 0.1mol/
l 水酸化ナトリウム水溶液、10倍に薄めた食酢、フェノールフタレイン溶液、ビュレット(50ml)、ホールピペット(10ml)、
コニカルビーカー(100ml)、ビーカー(100ml)、ろうと
【方法】
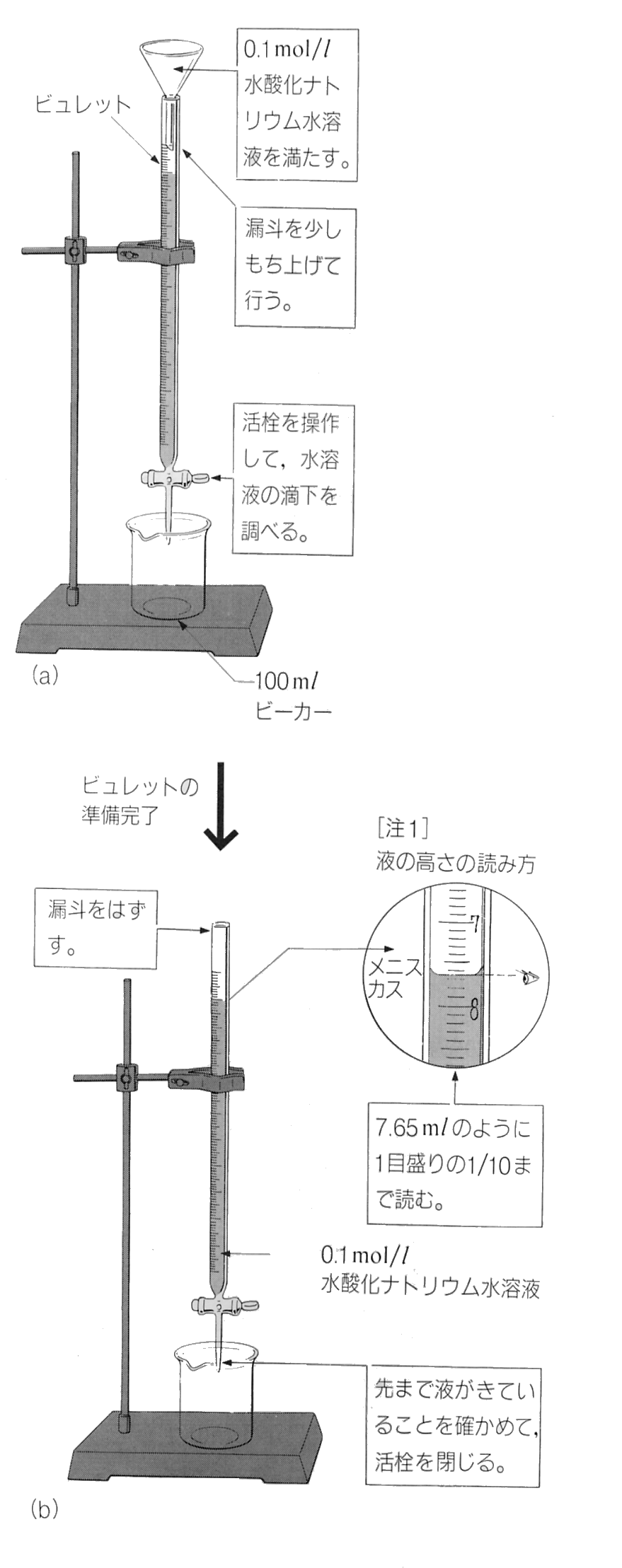
①ビュレットに、ろうとを用いて水酸化ナトリウム水溶液を入れる。
②ビュレットの下に100mlビーカーを置き、ビュレットの活栓を開いて、
液面を目盛りの読みやすい位置に合わせる。(はじめの目盛り:a[ml])。
目盛りは1/10まで読む。以下の操作でも同じ。
③コニカルビーカーに、10倍に薄めた食酢をホールピペットで10mlとり、
フェノールフタレイン溶液を1、2滴加える。
④ ③のコニカルビーカーに、ビュレットから水酸化ナトリウム水溶液を少し
ずつ滴下する。溶液の色がわずかに赤色を帯び、コニカルビーカーを静か
に振って色が消えなくなったら、滴下をやめる。このときのビュレットの目盛
りを読む(中和点の目盛り:b[ml])。
⑤ ②~④の操作を3回くり返し、各回の目盛りを記録する。
⑥中和に要した水酸化ナトリウム水溶液の体積の平均値を求める(表を作成)。
【結果】
1 中和に要した水酸化ナトリウム水溶液の量を下表のようにしてまとめて、
中和に要した平均の量v[ml]を求めよ。
|
|
はじめの目盛り :a [ml] |
中和点の目盛り :b [ml] |
中和に要した量 :(b-a) [ml] |
|
第1回 |
|
|
|
|
第2回 |
|
|
|
|
第3回 |
|
|
|
【考察】
1 この実験で起きた変化を化学反応式で表せ。
2 次の文の( )に適当な数値を記入して、食酢中の酢酸の質量パーセント濃度(%)を求めよ。
(1)水酸化ナトリウム水溶液の濃度C=( )mol/
l中和に要した水酸化ナトリウム水溶液の体積V=( )ml
10倍に薄めた食酢中の濃度C‘=x[mol/
l ]10倍に薄めた食酢の体積V‘=( )ml
(2) (1)の数値をCV=C‘V’に代入する。10倍に薄めた食酢中の酢酸の
濃度C‘(=x)=( )mol/
l 。(3)したがって、食酢(10倍に薄める前)中の酢酸の濃度X[mol/
l ]は、X= x × 10 = ( )mol/
l 。(4)食酢の濃度X[mol/
l ]は、1 l の食酢中に、酢酸が( )mol含まれていることを示している。
(5)次に、食酢1
l 中に含まれている酢酸の質量Y[g]を求めてみよう。酢酸CH3COOHの分子量は60.0であるから、
Y =60.0 × ( )mol よって、この質量=( )g。
(6)食酢の密度を1.0g/mlとすると、食酢1
l =(1000ml)の質量は( )gである。(7)食酢1
l 中の酢酸の質量パーセント濃度をZ(%)とすると、 ![]()
(8) 市販の食酢中のびんのらべるに記載してある濃度と、上で求めた値を比べてみよ。
【感想】
【実験で疑問に思ったこと】