柍婡壔妛偺棟榑亙僀僆儞壔孹岦偲偼亜 丂偦傕偦傕揹婥壔妛幚尡偺榖偱偁傞丅揹抮傪偮偔偭偰揹埵傪應掕偟偰暲傋偨偙偲偵側偭偰偄傞丅 丂偲偙傠偑丆棟榑揑偵偼偐側傝擄偟偄丅 丂俵倗乮倱乯乗嘆仺俵倗乮倗乯乗嘇仺俵倗俀亄乮倗乯乗嘊仺俵倗俀亄乮倎倯乯 丂嘆丂徃壺僄儞僞儖僺乕丂侾係俋丂倠俰乛倣倧倢 丂嘇丂僀僆儞壔僄儞僞儖僺乕丂俈俁俈亄侾係俆侽亖俀侾俉俈丂倠俰乛倣倧倢 丂嘊丂悈榓僄儞僞儖僺乕丂亅侾俋俀侾丂倠俰乛倣倧倢 丂嘆亄嘇亄嘊丂係侾俆丂倠俰乛倣倧倢 丂俠倎乮倱乯乗嘆仺俠倎乮倗乯乗嘇仺俠倎俀亄乮倗乯乗嘊仺俠倎俀亄乮倎倯乯 丂嘆丂徃壺僄儞僞儖僺乕丂侾俈俈丂倠俰乛倣倧倢 丂嘇丂僀僆儞壔僄儞僞儖僺乕丂俆俋侽亄侾侾係俆亖侾俈俁俆丂倠俰乛倣倧倢 丂嘊丂悈榓僄儞僞儖僺乕丂亅侾俆俈俈丂倠俰乛倣倧倢 丂嘆亄嘇亄嘊丂俁俁俆丂倠俰乛倣倧倢 丂傛偭偰丆俵倗偺傎偆偑僄僱儖僊乕忈暻偑崅偔側傝丆俠倎偺傎偆偑悈榓僀僆儞偵側傝傗偡偄偙偲偑暘偐傞丅 丂僀僆儞壔孹岦丂俠倎亜俵倗 丂偙偺応崌丆僀僆儞壔僄儞僞儖僺乕偑岠偄偰傑偡偹丅偟偐偟丆椉曽偲傕媧擬斀墳偵側偭偰偟傑偆丅 丂偲偙傠偑丆俠倎偺扨懱偼悈偲帺敪揑偵斀墳偡傞丅 丂俠倎丂亄丂俀俫俀俷丂仺丂俠倎乮俷俫乯俀丂亄丂俫俀 丂儮俫丂亖丂亅俈侽侽丂倠俰乛倣倧倢丂偱丆偐側傝偺敪擬斀墳偱偁傞丅忋婰偺寢壥偲柕弬偟偰偼偄側偄偐丠 丂偙傟偼丆悈暘巕偺壔妛寢崌偑愗傟傞偐傜偱丆娙扨側榖偱偼側偄両 亙壗偑捑揳偡傞偐丠亜 丂俀懓偺僀僆儞寢徎俵倃偑悈偵梟偗傞僄僱儖僊乕傪丆埲壓偺擇偮偵暘偗偰峫偊傞丅 丂俵倃乮倱乯乗嘆仺俵俀亄乮倗乯亄倃俀亅乮倗乯乗嘇仺俵俀亄乮倎倯乯亄倃俀 亅乮倎倯乯 丂嘆丂僀僆儞寢崌傪愗傞僄僱儖僊乕丅婥懱忬偺僀僆儞偵偡傞丅 丂嘇丂僀僆儞偑悈榓偡傞僄僱儖僊乕丅 丂嘆丂寢徎峔憿偑堎側偭偰傕丆偩偄偨偄俵偲倃偲偺娫偺嫍棧乮倰俀亄亄倰俀亅乯偵斀斾椺偡傞丅 丂丂丂俤侾乲倠俰乛倣倧倢乴亖俉丏俇亊侾侽俆乛乮倰俀亄亄倰俀亅乯 丂仼丂倰偺扨埵偼倫倣 丂嘇丂俵丆倃偦傟偧傟偺僀僆儞偺嫍棧乮倰俀亄丆倰俀亅乯偵斀斾椺偡傞丅 丂丂丂俤俀亄乲倠俰乛倣倧倢乴亖俀丏俈亊侾侽俆乛倰俀亄丂仼丂倰偺扨埵偼倫倣 丂丂丂俤俀亅乲倠俰乛倣倧倢乴亖俀丏俈亊侾侽俆乛倰俀亅丂仼丂倰偺扨埵偼倫倣 丂偄傑丆 丂儮亖俤侾亅俤俀亄亅俤俀亅 丂傪峫偊傞丅丂 丂倰俀亄亖俀侽倫倣丆倰俀亅亖俀侽侽倫倣乮俛倕俽俷係乯偺偲偒丆儮佮亅侾丏侾亊侾侽係倠俰乛倣倧倢 丂仺丂悈偵梟偗傞 丂倰俀亄亖侾侽侽倫倣丆倰俀亅亖俀侽侽倫倣乮俠倎俽俷係乯偺偲偒丆儮佮亅侾丏俀亊 侾侽俁倠俰乛倣倧倢丂仺丂捑揳偡傞 丂俛倕俽俷係偼俠倎俽俷係傛傝侾侽攞傕埨掕壔偟偰偄傞両 丂俛倕俀亄僀僆儞偑乽悈榓乿偵傛傝戝偒偔埨掕壔偡傞偐傜偱偁傞丅 丂堦斒揑偵丆乽彫偝側梲僀僆儞乿偲乽戝偒側堿僀僆儞乿偑寢崌偟偨僀僆儞寢徎偼丆悈偵梟偗傞丅 丂乮拲乯 丂嘆丆嘇椉曽偲傕乽揹壸偺俀忔偵斾椺偡傞乿偺偱丆僀僆儞偺壙悢偑堘偆応崌丆榖偼傕偭偲暋嶨偵側傞丅 亙僟僀儎儌儞僪偲崟墧亜 丂俠乮崟墧乯丂丂亄丂丂俷俀乮婥乯仺俠俷俀乮婥乯丂儮俫亖亅丂393.51丂kJ/mol丂乧丂嘆 丂俠乮僟僀儎儌儞僪乯亄俷俀乮婥乯仺俠俷俀乮婥乯丂儮俫亖亅丂395.35丂kJ/mol丂乧丂嘇 丂嘆亅嘇 丂俠乮崟墧乯仺俠乮僟僀儎儌儞僪乯丂儮俫亖亄丂1.84丂kJ/mol 丂僟僀儎儌儞僪傛傝崟墧偑埨掕偱偁傞丅崟墧偼兾揹巕偺旕嬊嵼壔偵傛傝丆戝偒偔埨掕偟偰偄傞丅偙偺埨掕壔偺偨傔偵丆扽慺偼憌忬峔憿傪偲傞偺偱 偁傞丅 亙俠俷偲俠俷俀亜 丂俠俷俀偼丆倱倫崿惉婳摴傪峫偊傞偲丆侾俇屄偺壙揹巕偺偆偪丆冃寢崌偵侾俀屄丆兾寢崌偵係屄偑巊傢傟傞丅偙偺兾寢崌偼俀偮偑屳偄偵 捈岎偟偰偄傞丅堦曽偱丆暘巕婳摴朄偵傛傞偲丆冃寢崌偵俉屄丆兾寢崌偵俉屄偑巊傢傟傞丅偙偺俉偮偺兾揹巕偼丆屳偄偵捈岎偡傞柺偵係揹巕偯偮俁 偮偺尨巕偵傢偨偭偰暘晍偟偰偍傝丆傛傝俠俷俀偺宍傪儕傾儖偵嵞尰偟偰偄傞偲尵偊傞丅 丂堦曽偱丆俠俷偼擄偟偄丅暘巕婳摴朄偵傛傞偲丆俠俷偼俁廳寢崌偲峫偊傜傟丆俷偐傜俠傊揹巕偑嫙媼偝傟偰偄傞丅偟偨偑偭偰丆嬌惈偑庛傔傜傟丆俠俷偼悈偵乽梟 偗側偄乿偲峫偊傜傟傞丅乽揹婥堿惈搙乿傪峫偊傞偲丆俷偐傜俠傊揹巕偑嫙媼偝傟偰偄傞偺偼晄巚媍偱偁傞偑丆乽揹婥堿惈搙乿偼扨寢崌偺幚應僨乕僞傪棙梡 偟偨栚埨偱偁傞丅擇廳丒嶰廳寢崌偺揹巕偼丆偙偺乽揹婥堿惈搙乿偲偼媡偺嶌梡傪偟偰偄傞偙偲偵拲栚偟偨偄丅 丂丂 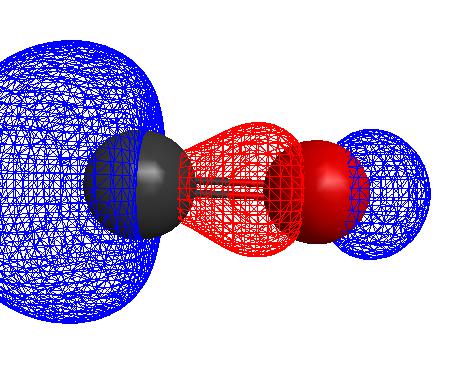 丂忋偺恾偼丆俠俷偺俫俷俵俷傪丆俥倝倰倕倖倢倷偲偄偆僜僼僩偱丆婎掙娭悢傪俇亅俁侾俧乮倓乯偲偟偰寁嶼偟偨傕偺偱偁傞丅崟娵偼俠丆愒娵偼俷偱偁傞丅俠尨巕偺奜懁偵揹巕偑戝偒偔挘傝弌偟偰偄傞偙偲偵拲栚偟偨偄丅嬥懏偵懳偟偰丆俠俷偺俠偑攝埵寢崌偡傞偙偲偑暘偐傞丅 丂俠俷俀偲俠俷偺惗惉僄儞僞儖僺乕偼丆偦傟偧傟丆亅俁俋係倠俰乛倣倧倢丆亅侾侾侾倠俰乛倣倧倢偱偁傝丆丂俠俷俀偺 傎偆偑偼傞偐偵乽埨掕乿偱偁傞丅偲偙傠偑丆俠乮崟墧乯傪崅壏偱擬偡傞偲俠俷偑偱偒傞丅偙傟偼偳偆偟偨傕偺偐丠 丂俠乮崟墧乯亄俷俀丂丂丂丂丂仺俠俷俀 婥懱偺暘巕悢偼丆曄壔偑側偄丅 丂俠乮崟墧乯亄乮侾乛俀乯俷俀仺俠俷 婥懱偺暘巕悢偼丆乮侾乛俀乯暘巕偩偗憹壛偡傞丅僄儞僩儘僺乕憹戝偱偁傞両 丂俧亖俫亅俽俿側偺偱丆崅壏傎偳僄儞僩儘僺乕岠壥偑岠偔丅 丂幚嵺偵寁嶼偡傞偲丆俈侾侽亷傪嫬偵俠俷惗惉偑桪惃偲側傞丅 亙俶俷偲俶俷俀亜 丂俶俷偼婏悢揹巕暘巕偱偁傞丅巁慺偐傜拏慺偵揹巕偑嫙媼偝傟丆俀廳寢崌偲俁廳寢崌偺拞娫偺峔憿傪偲傞偲峫偊傜傟傞丅偦偙偱丆俶俷偼嬌惈偑彫 偝偔側傝丆悈偵梟偗側偔側傞偲尵傢傟傞丅俷偺傎偆偑乽揹婥堿惈搙乿偑戝偒偄偑丆壗搙傕尵偆傛偆偵丆偦傕偦傕乽揹婥堿惈搙乿偲偄偆傕偺偼懡廳寢崌偵 偮偄偰偼丆廫暘側愢柧傪梌偊傞偙偲偑偱偒側偄丅 丂俶俷俀傕婏悢揹巕暘巕偱偁傞丅偙偪傜偼丆俶俷傛傝傕廫暘偵揹巕偑旕嬊嵼壔偟偰偄側偄偺偱丆晄懳揹巕偑巆傞丅偦偙 偱丆擇検壔偟偰俶俀俷係偵側傞丅 亙倫兾亅倓兾寢崌亜 丂戞嶰廃婜偺尨巕偲巁慺尨巕偺寢崌偵偍偄偰丆戞嶰廃婜偺尨巕偺俁倫婳摴偲俁倓婳摴偺僄僱儖僊乕偼棧傟偰偍傝丆婎杮揑偵崿惉婳摴傪宍惉偟側 偄丅偟偐偟丆戞嶰廃婜偺尨巕偺俁倓婳摴偼丆巁慺尨巕偺俀倫婳摴偲廳側傝崌偭偰寢崌傪偮偔傞応崌偑偁傞丅 丂戞嶰廃婜偺尨巕偺俁倫婳摴偺偟傖傊偄岠壥偼彫偝偄偺偱丆俁倓婳摴偼俽倝仺俹仺俽仺俠倢偲彫偝偔側傞丅巁慺偺俀倫婳摴偲戞嶰廃婜偺尨巕偺俁倓婳摴偺廳側傝 偼丆婳摴偺戝偒偝偑嬤偄傎偳傛偔廳側傞偺偱丆俽倝仺俹仺俽仺俠倢偲戝偒偔側傞丅偟偨偑偭偰丆巁慺偲偺寢崌偼丆俽倝仺俹仺俽仺俠倢偲戝偒偔側傞丅 丂偦偺寢壥丆 丂俽倝亅俷丂仺扨寢崌嫄戝暘巕丅丂丂俹亅俷丂仺丂廳崌偡傞丅丂丂俽亖俷丆俠倢亖俷丂仺丂擇廳寢崌偵側傝丆廳崌偟側偄丅 亙倓婳摴偺崿惉亜 丂俹俠倢俆偼懚嵼偡傞偑丆俹俫俆偼懚嵼偟側偄丅偙傟偼丆偳偆偄偆偙偲偱偁傠偆偐丠 丂俹尨巕偵俠倢尨巕偺傛偆側乽揹婥堿惈搙偺戝偒側尨巕乿偑懡悢寢崌偡傞偲丆俹尨巕偼乽戝偒側乿惓揹壸傪傕偮丅 丂俹尨巕偺嵟傕奜懁偵偁傞俁倓婳摴偼廂弅偟丆尨巕妀偲偺嫍棧偑嬤偔側傞偺偱丆婳摴偺僄僱儖僊乕偑壓偑傞丅倓婳摴偺僄僱儖僊乕偼丆倱婳摴傗倫婳摴偵愙嬤偡 傞丅僄僱儖僊乕偑嬤偄偲崿惉偡傞偙偲偑偱偒丆倱倫俁倓崿惉婳摴傪宍惉偡傞丅 亙擬偺揱傢傝曽亜 丂俀偮偺梫場偑偁傞丅 丂嘆丂尨巕偺怳摦 丂嘇丂帺桼揹巕乮嬥懏偺応崌乯 丂堦斒揑偵偼丆嬥懏偺傎偆偑擬傪傛偔摫偔丅帺桼揹巕偑偁傞偐傜偱偁傞丅偲偙傠偑丆峝偄僟僀儎儌儞僪偼椺奜揑偱丆嬥懏偺帺桼揹巕傛傝傕丆扽慺偺尨巕怳摦偑懍 偔擬傪揱偊傞丅嬧傛傝傕擬揱摫棪偑俆攞傕戝偒偄丅 |