| シリアル番号 | 表題 | 日付 |
|
967 |
二酸化炭素と海洋表層の酸性化 |
2005/07/07 |
英王立協会の2005/6/30がサミットにあわせ発表した報告書によると現在の海面付近のpHは8.1。
産業革命時より0.1低い。これは海水中の水素イオンが30%増えたことになる。2100年には7.2-7.9まで下がる。深海との混合速度が追いついていない。
この影響でサンゴ礁の劣悪化と炭酸カルシウム(CaCO3)の殻を持つプランクトンを減少させて食物連鎖を乱し、漁業に深刻な影響をもたらすと指摘。
ニューヨークタイムズ2005/7/1
2006年のIPCC報告Chapter6:Ocean Storageによると正確な説明は:
大気中の二酸化炭素(CO2(g))は海水(H2O)中の炭酸(H2CO3(aq))、重炭酸イオン(HCO3-)、炭酸イオン(CO32-)、と水素イオン(H2+)と平衡になっている。
海洋にはpH値を左右する水素イオン(H2+)や水酸イオン(OH-)を凌駕する多量のアルカリ金属イオンが溶け込んでいるため、緩衝溶液となっている。炭酸カルシウムの溶解度は海深が増すと大きくなる。逆に表層では過飽和状態になっている。このため海洋生物がサンゴ礁や珪藻類がその骨格をつくることが出来ている。光合成 して成長した珪藻類の死骸は深海に落ちてゆき、そこでCaCO3は再溶解される。
海水に二酸化炭素が新たに加わると
CO2 + H2O + CO32- ⇒ 2HCO3-
CO2 + H2O ⇔ H2+ + HCO3-
の平衡がずれて 炭酸イオンが重炭酸イオンに変わり、水素イオンが増えてpHが下がると下式の炭酸カルシウムによる中和が生じ、実際にはpHは低下しない。
CaCO3(s) + CO2(g) + H2O ⇔ Ca2+ + 2HCO3-
しかし表層の過飽和の炭酸カルシウムが消費されつくされれば表層は完全に酸性化される。

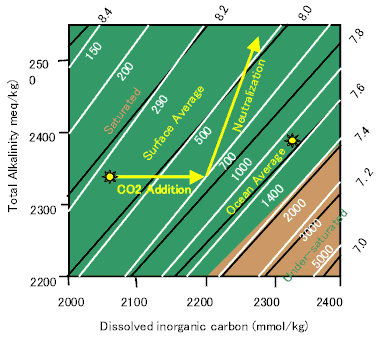
これをバエスの図で表現すると上のようになる。ここでeqはアルカリ度の単位で海水中の水中に含まれるアルカリ分の総量に対応する。アルカリ成分(OH-やCO32-)をこれに対応する炭酸カルシウム(CaCO3)の量に換算して表したもの。
白線と白文字は二酸化炭素分圧をppmで表示し。黒線はpH値を示している。緑色の領域は炭酸カルシウムが過飽和の領域で、褐色の領域は不飽和の領域である。表層の平均組成と海洋全体の平均 組成も表示してある。
二酸化炭素が海に溶けるとアルカリ度一定のまま溶存無機炭素量が増す。そうするとと1年くらいかけて炭酸カルシウムが溶解してアルカリ度と溶存無機炭素量の双方が増 する。二酸化炭素1モルに対し2モルの炭酸カルシウムが溶解する。
Rev. January 7, 2008