1. HTSとは何か?
1−1.定義
1−2.創薬研究における位置づけ
1−3.HTSシステムの概要
〇化合物の溶液ライブラリー
化合物収集、ダイバーシティー、CC、天然物エキス等
〇アッセイ系について
インビトロスクリーニングの基礎、HTSアッセイ系を作る技術等、測定法
〇HTSの実施とオートメーション
プーリング法、プレート、ロボットシステム、評価基準の設定
6.データー処理
6−1.データー処理システムの現状
〇今後のHTSを考える
という予定で順不同で書いていきます。なるべく実践的、具体的に記述したいと思います。
こうご期待を、ということで次にいきましょう。
現在、多くの製薬企業では新しい戦略としてCCやHTSに取り組んでいます。CCについても後で軽く触れますが、ここではHTSの解説が主題です。
先ずはHTSとは何か?から解説を始めましょう。
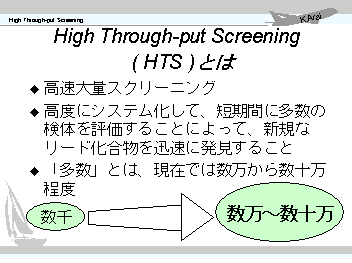 |
HTSは "High Through-put Screening"
の頭文字を取ったもので、特に日本語訳はありませんが、敢えて訳す必要がある時には、私は「高速大量スクリーニング」と訳しています。HTSとは、「高度にシステム化した方法で短期間に多数の化合物を生化学的に評価して、新規なリード化合物(ヒット化合物)を迅速に発見すること」である。 それでは、短期間とはどのくらいか?、多数とはどのくらいか?、ということが問題になってきます。当然、その時代の技術レベルや戦略によって変わってきますが、現在では2,3ヶ月から半年程度で数万から数十万検体程度のスクリーニングを実施すると考えておけば良いでしょう。 そして、高度なシステム化とは何かということですが、まあ待ってください。それをこれから解説していきます。先ずはその前に、背景等の解説からいきます。 |
 |
一つの医薬品を開発するには10年以上の月日を必要としますが、医薬開発研究は、創薬研究と開発研究とに大きく分けられます。開発研究では、開発候補物質の前臨床試験、フェーズⅠ・フェーズⅡ・フェーズⅢによる臨床試験を行います。その後、厚生省に申請を行い、承認されたものが新薬となります。 |
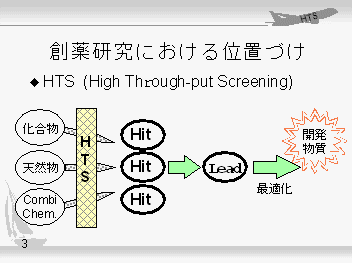 |
この開発物質を生み出すのが創薬研究であり、ここでも医薬の種となるリード化合物を見出すまでの探索段階とリード化合物を合成展開して化合物の最適化を行う創薬段階とに分けられます。リード化合物の選定方法は、特許や文献等からの情報調査によってすることもありますが、天然物や合成化合物にいわゆるランダムスクリーニングによって新しい薬効を見出す方法があります。このランダムスクリーニングを極めて効率的に実施しようとするのがHTSということになります。 |
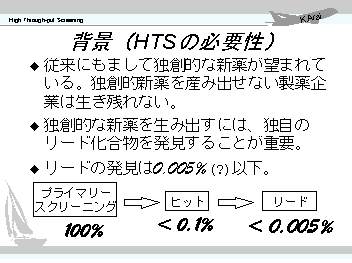 |
では、なぜいまHTSが注目されているのでしょうか。それは、今後は製薬企業が画期的な新薬を開発できなければ生き残れないとの背景があるからです。医薬業界の国際化にともない、医薬品の承認のあり方が変わり、他社の物まねでは承認が得られなくなります。様々な意味で国際的な競争力がなければ製薬企業としてやっていけなくなってきたのです。 ところで、スクリーニングによってリードをだすにはどのくらいの化合物を評価しなければならないのでしょうか。過去の統計データーを参考にすれば、スクリーニングによって見出された生理活性のある化合物(いわゆるヒット化合物)を見出す確立は0.1%以下、これらヒット化合物からリード化合物になりうるのが5%以下ということになると、実に2万化合物から1個のリードが出てくるかどうかという世界になります。そして、実際の数字もこれに近いものが出ています。ここに、HTSの必要性が出てくるのです。 |
このようにして、現在日本の製薬企業はここ数年HTSに取り組んできました。欧米では5,6年前よりこうした動きが活発になっていましたが、日本でもようやくスタートラインに立ったという状況であると思われます。
ここで、あらためてヒットとリードを明確に定義しておきましょう。
ヒット(Hit)とは、スクリーニングによって、目的の薬効に対して確かに活性があると認められた化合物である。
リード(Lead)とは、本格的に合成展開して化合物の最適化を実施する元となる化合物である。ヒットの中から、非特異的な活性、物性、毒性や合成展開性等様々な観点から選ばれた化合物である。
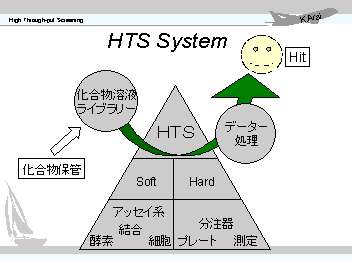 |
HTSは、ただ単に多数の検体をスクリーニングするためのアッセイ技術のことだけではありません。評価するべき化合物資源を溶液としてライブラリー化すること始め、アッセイそのもの、そして測定データーの処理までをシステム化し、それらの過程でロボット等のオートメーション技術を効率よく応用して、トータルのスループットをあげることを目差します。 HTSが従来のマススクリーニングと概念的に異なるのは、単にスクリーニングに供する数を問題にするだけではないというところにあります。そして最も重要なことは、スクリーニングそれ自体が単に付属的な技術から脱皮して、一つの技術(または学問)分野として認識できるようになってきたことであります。スクリーニングに携わる皆さん!みんなでスクリーニングの地位をあげましょう!。 |
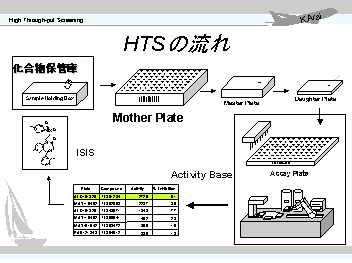 |
HTSの流れをみてみましょう。左の図のように、保管化合物を先ず溶液としてライブラリー化します。ここではMother
Plateとなっていますが、Strage Plateと表現するところもあるようです。通常、96穴マイクロプレートと呼ばれる12行8列に穴の空いたプレートに80種類または88種類の化合物溶液を配置します。これを一般に、「化合物ライブラリーまたは化合物溶液ライブラリー」と呼びます。このマザープレートから何段階か希釈してドータープレートを作成します。このドータープレートから様々なアッセイに化合物を添加して化合物の活性評価を実施するわけです。アッセイ法については別のセクションで解説します。 アッセイが終了して測定データーを取得したら、このデーターをデーター処理して活性を一般には数値としてあらわします。こうして活性の確認された化合物は更に活性の再現性のテストや濃度依存性を確認することになります。こうして活性の確認された化合物がHitとして認定されます。活性のデーターはデーターベースとして保存され、またその化合物の構造は化合物データーベースとリンクしてその構造等を確認したりします。 このHTSの一連の作業の中に、極めて効率的にスクリーニングを実施するために、化合物の多様性、溶液の調整、プレートの作成、アッセイ技術、オートメーションによるアッセイ実施、各種測定器と測定法、そしてデーター処理とデーターベース等様々な取り組みがなされています。 |
化合物収集と保管 | |
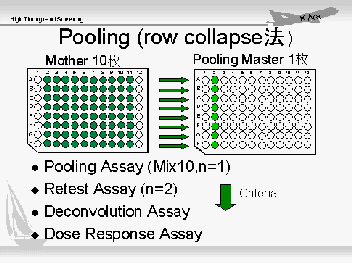 |
○ POOLINGプレート: 多数の検体をスクリーニングする手法の一つにプーリング1)という手法があります。評価検体を5〜10検体程度混合してスクリーニングを効率化しようとする方法です。活性の確認された混合検体は、次に化合物を一つ一つ別々にアッセイ(Deconvolution
Assay)して活性物質を特定します。 POOLINGの主な作成法を紹介します。 ・ Row Collapse法: プレートの横一列を一つのウェルに入れる。この場合10又は11検体が混合されます。 ・ Column collapse:プレートの縦一列を一つのウェルに入れる。 ・ Stack法:例えば10枚のプレートを串刺しするように混合する。 スタック法なら96穴同時分注器を使って簡単に作れますが、活性検体をデコンボルーションする時は、10枚のプレートから一つずつピックアップしなければならないデメリットがあります。各Collapse法では、テカン社のジェネシスという分注器を使うのが便利です。ジェネシスでは、8本のニードルを同時に使うことも個々別々に使うことも可能なので、自由に検体のピックアップをして、好きな場所(ウェル)に分注することができるからです。 |
 |
○ チェリーピッキング: 通常、1次アッセイで活性のあった検体は、再現性試験でその活性を確認します。その際、活性検体だけを集めたプレートを作成する必要があります。数万数十万検体の中から、数十〜数百の検体をピックアップすることをチェリーピッキングと呼んでいます。テカン社のジェネシスを使ったシステム等があります。本シリーズで詳しく解説する予定です。 |
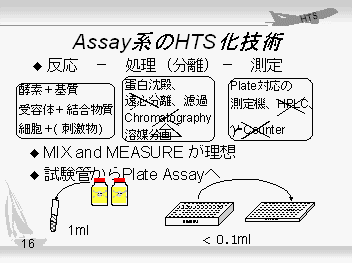 |
まずは、アッセイ系のしくみを考えてみましょう。アッセイのプロトコールは[反応]、[処理]、[測定]の3段階に分けられます。 例えば、酵素阻害アッセイ( Enzyme assay )では、酵素(enzyme)、基質(substrate)と検体、結合阻害アッセイ(Binding assay)では、受容体(receptor)、と結合物質(ligand)と検体、細胞系アッセイ(Cell-based assay)では、細胞、刺激物質(必ずしも使うとは限らないが)と検体というように、何らかの反応を行います。 次に、未反応物を除去する等の分離操作を行って、反応の後処理・測定の前処理を行います。 最後に、どの程度反応が進んだか、または阻害されたかを定量的に測定することになります。 以上の3段階の内、[反応]と[測定]のステップは省略しようがありませんが、中間の[処理]ステップをいかに簡単に行うかが、HTSを考えたアッセイ系構築のポイントになります。 以下に、このmix and measureの方法について代表的なものを解説することにします。 |
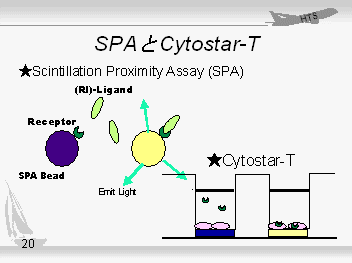 |
まず最初は "SPA"と呼ばれる技術です。この方法は Amersham Pharmacia Biotech社の特許になっていて、使用するためには基本的には契約が必要になります。 SPAとは Scintillation Proximity Assayの頭文字を取っています。Scintillationとは光がピカピカと瞬くことで、Proximityとは近傍つまり近くにあることです。例えば、次に示すような方法でリセプターをSPAビーズに結合させ、これとRI標識したリガンドとを混合させます。リセプターに結合したリガンドはSPAビーズと距離が近くなるためリガンドからでるβ線によってSPAビーズ内のシンチレーターが光るというしくみです。結合していないリガンドは影響がないので、混ぜた状態で(B/F分離することなく)結合状態をを測定するすることができます。 Cytostar-Tはこの方法を細胞培養用96穴プレートに応用したものです。各Wellの底面にはシンチレーターが含まれており、もし、細胞内にRI標識化合物が取り込まれるとプレート底面が光るというしくみです。こちらも、原則的にはアマシャム社と契約が必要なのですが、なんとSPA契約と別契約なのです。 |
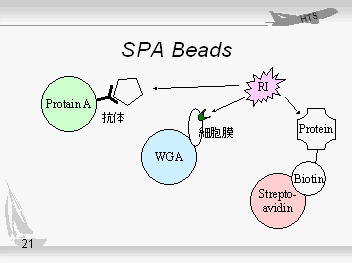 |
SPAには左のような種類があります。Protein Aビーズは抗体を会して、細胞膜の場合はWGAビーズで、タンパクをビオチン化してストレプトアビジンビーズとつける等の方法があります。 既存に存在するタンパクを使う場合は、これらいずれかの方法を選択検討してアッセイ系を構築することになりますが、もし遺伝子操作によってタンパクを作成する場合は、例えばFcキメラタンパクとして発現させれば、そのままプロテインAビーズに結合させることができるという大きなメリットがあります。 ここに、アッセイ系構築のための重要なポイントがあります。つまり、遺伝子操作をする人がアッセイ系のイメージを持つかどうかで、良いアッセイ系が作れるかどうかが決定的に違ってくるということです。(1999/06/10) |
 |
次は、最近はやりのリポータージーンアッセイです。 疾患に関わっていると考えられる蛋白質をコードする遺伝子には、その上流にmRNAへの転写開始をコントロールする転写調節領域が存在します。遺伝子操作技術によって、その転写領域を切り出して、例えばホタルの発光を触媒するルシフェラーゼという酵素をコードした遺伝子を持つベクター(プラスミド・環状DNA)に組み込みます。このプラスミドを適当な細胞に組み込んで発現細胞(transfectant)を作成します。この発現細胞は、目的のタンパク発現に関与した転写領域の管理下、目的のタンパクの代わりにルシフェラーゼを産生します。即ち、この細胞を使って、目的のタンパクの産生を調節する物質をルシフェラーゼの活性に置き換えてスクリーニングすることができるわけです。この化学発光は極めて高感度なので、良い細胞さえ作成すれば、2000個程度の細胞で十分な感度を得ることができるため、384穴プレートを使ったHTSも可能になります。 ルシフェラーゼの代わりにアルカリフォスファターゼやGFP(緑の蛍光を出すタンパク)を使ったりすることもあります。 このアッセイ法も、細胞に検体化合物を添加して一定時間後に、SteadyGlow (Promega社)やLuclite (Packard社)といった発光基質を加えるだけで高感度で測定できます。(1999/08/15) |
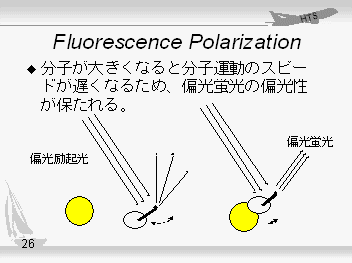 |
○ FP(Fluorescence Polarization, 偏光蛍光法):蛍光発色団をもった分子に偏光励起光をあてると、分子の運動に依存して蛍光の偏光性に違いが生じる。分子量が大きいほど分子の運動はゆっくりであるため、蛍光の偏光性が保存されることになる。例えばFITCラベルしたペプチドが蛋白質と結合する場合では、見かけ上の分子量が変化して蛍光の偏光性に変化が生じるため、偏光性を測定することで、ペプチドとタンパクの結合量を測定する方法である。測定器はLJL BiosystemのAnalystとAquestがあり、それぞれ96/384対応と384/1536対応の機種である |
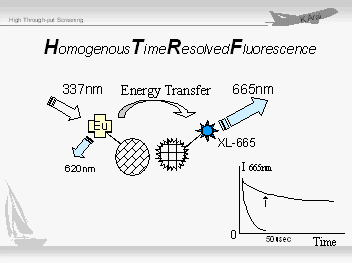 |
○ HTRF(Packard社)またはLANCE(wallac社):いずれも原理は同じ均一系時間分解蛍光法のことである。ユーロピウム標識された分子と蛍光標識された分子が結合した際に、励起されたユーロピウムからのエネルギー転移によって長時間蛍光が生じます。両分子が結合しない場合は短時間50μ秒以下で減衰するため、長時間蛍光のみを測定することで、分離操作なしに結合量を測定する方法である。Packard社のDiscoveryが専用器だが、Wallac社のALVOシリーズでも測定は可能である。最近は、Wallac社からViewluxという高密度プレート対応型の画像処理型測定器も開発されています。 |
企画中
ロボットシステム、評価基準の設定
企画中
 |
HTSシステムの構築にデーター管理・処理システムが不可欠です。一日に数千からのデーターが出てくるHTSで、表計算ソフト等で処理していたのではデーター処理に時間がかかってしまい、せっかくアッセイを効率化した意味がありません。ましてや一つのスクリーニングで何万からのデーターが発生します。年間に20系10万実施すれば、実に200万のデーターが発生します。あるヒットが生まれた時に、そのヒット化合物やその周辺化合物に過去どのような評価結果があったのか等検討する際にデーターベースなくしては語れないでしょう。 現在あるHTS用データー処理ソフトウエアは、米国MDL社の"Screen"、英国IDBS社の"Activity Base"と"RS3"(RS cube)の三つがあります。RS3のことはほとんど知らないので言及は避けます。が、ほかの両者はいずれもOracleベースのデーターベースソフトであり、クライアント・サーバーシステムで稼動します。当然、各社にあるそれぞれの化合物データーベースとリンクする必要があります。現在、化合物の構造を取り扱うソフトウエアとしては、国際的にMDL社の"ISIS Base"、"ISIS Draw"が標準になっています。(MacでChemDrawを使っているなんてのはせいぜい日本の大学くらいなものでしょう。)いずれもISISとの連携に関してはそれほど問題ありませんが、現時点での両者の仕様や使い勝手は大きく異なっています。比較表を載せようかとも思いましたが、国内動向は既にハッキリしてしまいましたので、今更ということでやめておきます。 |
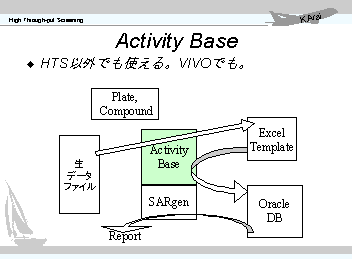 |
ABaseのユーザーの集まりで構成する「IDBSユーザー会」がつい先日発足することが決まったとのことです。(1999年6月) ABASEでは、各評価系ごとにエクセル上でテンプレートを作成すれば、60枚程度のアッセイプレート(約5000検体)のデーターが15〜20分程度で集計され、同時にデーターベースに登録されます。ロボットシステムの測定結果に対して自動処理の設定さえしておけば、夕刻にスクリーニングロボットの自動アッセイをスタートさせると、夜間にロボットがアッセイを自動的に行い、測定データーをネットワーク経由でABASEが監視するハードディスクに保存し、ABASEが自動的にデーター処理、データーベースへの登録を行ってくれるということも可能です。実験者は翌朝、ABASEをみると昨日のアッセイでの活性検体を確認することができるということになります。 |
これらのソフトを購入しない場合は、いわゆる"in house"のソフトを開発するか、Microsoft Excel等のような表計算ソフトを利用することになります。しかし、Excelだけでは大規模データーベースにならないし、"in house"のソフト開発はよほどの天才プログラマーがいない限り、短期間でこうしたレベルの実用的なソフトを開発することは、はっきり言って不可能なので、ほとんど良いことはありません。大きくなってしまった(または頭の固い)ソフト開発部門を抱えてしまった会社の不幸がここにあります。
国際的にも流れはABaseになりつつあり、Screenの巻き返しがなるかというところですが、Screenの現在のバージョンではまだ不可能でしょう。ただ、ABaseに問題がない訳ではありません。というより問題だらけで、まだまだ出来損ないであるといっても良いぐらいです。それでもABaseなのは、欠点が致命的ではないこととやはり優れたものを持っているからです。うまく使いこなせば、絶対有益なので、みなさん頑張りましょう。
最後に、
Activity Baseは CTCラボラトリーシステムズ社が
ScreenはMDLジャパン社で取り扱っています。
RS3HTSは富士通で取り扱っています。
(今日はここまで。順次順不同書き足しますのでよろしく。)